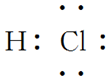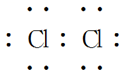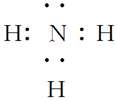概率预测 | ☆☆☆☆☆ |
题型预测 | 解答题☆☆☆☆☆ |
考向预测 | 有关晶体的计算 |
秘籍
物质结构与性质主观大题在近几年高考中出现频率达100%。稳定加创新是本专题的基本特点,命题采取结合新科技,新能源等社会热点为背景,命题的形式没有太大的变化,原子的结构与性质、分子的结构与性质和晶体的结构与性质是命题的三大要点。从大题的构成来看,给出一定的知识背景,然后设置成3—4个小题,每个小题考查一个知识要点是主要的命题模式,内容主要考查基本概念,如电子排布式,轨道式,电离能,电负性,杂化方式以及空间构型等,也可联系有机考查有机物中C原子的杂化,联系数学几何知识考查晶体的计算等,一般利用均摊法考查晶胞中的原子个数,或者考查晶体的化学式的书写、晶体类型的判断等,考查的抽象思维能力、逻辑思维能力;同时培养学生的分析和推理能力。
知识点
一、原子结构与性质
知识点一原子核外电子排布原理
1.能层、能级与原子轨道
(1)能层(n)
在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N……表示,能量依次升高。
(2)能级
同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道
电子云轮廓图给出了电子在核外经常出现的区域。这种电子云轮廓图称为原子轨道。
原子轨道 | 轨道形状 | 轨道个数 |
s | 球形 | 1 |
p | 哑铃形 | 3 |
【特别提醒】第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
(4)能层、能级与原子轨道之间的关系
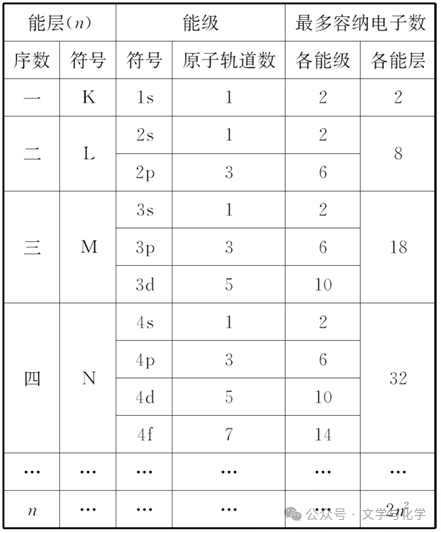
2.原子轨道的能量关系
(1)轨道形状
①s电子的原子轨道呈球形。
②p电子的原子轨道呈亚铃形。
(2)能量关系
①相同能层上原子轨道能量的高低:ns<np<nd<nf。
②形状相同的原子轨道能量的高低:1s<2s<3s<4s……
③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如npx、npy、npz轨道的能量相等。
④不同能级具有交错现象ns<(n-2)f<(n-1)d<np。
3.基态原子的核外电子排布
(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。即原子的核外电子排布遵循构造原理能使整个原子的能量处于最低状态。
如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图:
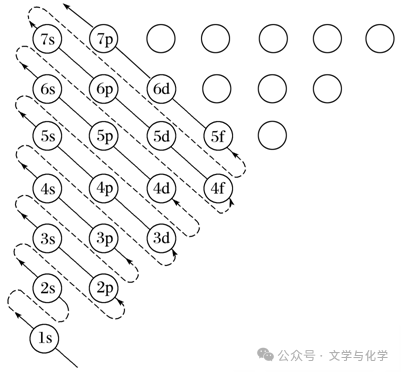
【特别提醒】所有电子排布规则都需要满足能量最低原理,这个填充顺序可以根据n+0.7l规则计算出来,n为电子层数,l为轨道类型数,s、p、d、f取值分别0、1、2、3。
(2)泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
如2s轨道上的电子排布为
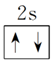
,不能表示为
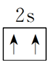
。
(3)洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。如2p3的电子排布为
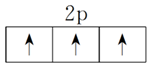
,不能表示为
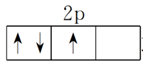
或
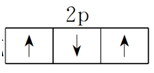
。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1。
4.原子(离子)核外电子排布式(图)的书写
(1)核外电子排布式:按电子排入各能层中各能级的先后顺序,用数字在能级符号右上角标明该能级上排布的电子数的式子。如Cu:1s22s22p63s23p63d104s1,其简化电子排布式为[Ar]3d104s1。
(2)价电子排布式:如铁原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
(3)电子排布图(或轨道式):方框表示原子轨道,用“↑”或“↓”表示自旋状态不同的电子,按排入各能层中的各能级的先后顺序和在轨道中的排布情况书写。例如:
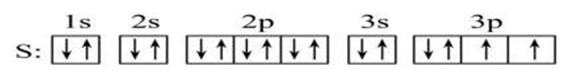
,核外电子排布图能直观地反映出原子的核外电子的自旋情况以及成对电子对数和未成对的单电子数。
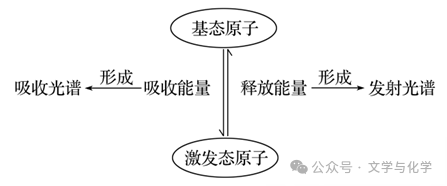
5.基态、激发态及光谱示意图
(1)原子状态
①基态原子:处于最低能量的原子。
②激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。
(2)原子光谱:
①当电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,释放一定频率的光子,这是产生原子发射光谱的原因。
②不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。利用原子光谱的特征谱线可以鉴定元素,称为光谱分析
(3)基态、激发态及光谱示意图
二、元素周期律
1)原子半径
(1)影响因素
能层数:能层数越多,原子半径越大
核电荷数:能层数相同,核电荷数越大,原子半径越小
(2)变化规律:元素周期表中的同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大。
2)电离能
(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号:I1,单位:kJ·mol-1。
(2)规律
①同周期:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,总体呈现从左至右逐渐增大的变化趋势。
②同族元素:从上至下第一电离能逐渐减小。
③同种原子:逐级电离能越来越大(即I1<I2<I3…)。
【特别提醒】第二、三、四周期中,第ⅡA族、第ⅤA族元素的第一电离能比相邻元素都大。
(3)应用
①判断元素金属性的强弱:电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。
②判断元素的化合价:如果某元素的In+1≫In,则该元素的常见化合价为+n,如钠元素的I2≫I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况:多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
3)电负性
(1)含义:元素的原子在化合物中吸引键合电子能力的标度。元素的电负性越大,表示其原子在化合物中吸引键合电子的能力越强。
(2)标准:以最活泼的非金属氟的电负性为4.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
(3)变化规律:
①金属元素的电负性一般小于1.8;
②非金属元素的电负性一般大于1.8;
③位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。
④在元素周期表中,同周期从左至右,元素的电负性逐渐增大,同主族从上至下,元素的电负性逐渐减小。
(4)应用
①判断元素的金属性和非金属性。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。
②判断化合物中元素化合价的正负。电负性数值小的元素在化合物吸引电子的能力弱,元素的化合价为正值;电负性大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
③判断分子的极性和键型。电负性相同的非金属元素化合形成化合物时,形成非极性共价键,其分子都是非极性分子;通常认为,电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物。
4)对角线规则:在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如
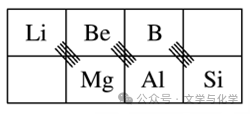
。
三、微粒间的相互作用力
1.共价键与离子键的比较
离子键 | 共价键 | ||
非极性键 | 极性键 | ||
概念 | 阴、阳离子通过静电作用所形成的化学键 | 原子间通过共用电子对而形成的化学键 | |
成键粒子 | 阴、阳离子 | 原子 | |
成键实质 | 阴、阳离子的静电作用 | 共用电子对不偏向任何一方 | 共用电子对偏向一方原子 |
形成条件 | 活泼金属元素与活泼非金属元素经电子得失,形成离子键 | 同种元素原子之间成键 | 不同种元素原子之间成键 |
形成的物质 | 离子化合物 | 非金属单质;某些共价化合物或离子化合物 | 共价化合物或离子化合物 |
2.σ键与π键的判断方法
(1)由轨道重叠方式判断。“头碰头”重叠为σ键,“肩并肩”重叠为π键。
(2)由物质的结构式判断。通过物质的结构式可以快速有效地判断共价键的种类及数目。共价单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两个π键。
(3)由成键轨道类型判断。s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ键。
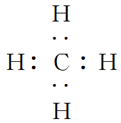
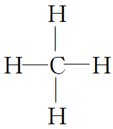
3.几种典型物质的电子式、结构式和模型:
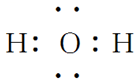
物质 | HCl | Cl2 | H2O | NH3 | CH4 |
电子式 |
|
|
|
|
|
结构式 | H—Cl | Cl—Cl | H—O—H |
|
|
球棍模型 |
|
|
|
|
|
比例模型 |
|
|
|
|
|
4.共价键类型的判断
(1)σ键与π键
①依据强度判断:σ键的强度较大,较稳定;π键活泼,比较容易断裂。
②共价单键都是σ键,共价双键中含有1个σ键、1个π键,共价叁键中含有1个σ键、2个π键。
(2)极性键与非极性键
看形成共价键的两原子,不同种元素的原子之间形成的是极性共价键,同种元素的原子之间形成的是非极性共价键。
【特别提醒】 (1)只有两原子的电负性相差不大时,才能形成共用电子对,形成共价键,当两原子的电负性相差很大(大于1.7)时,不会形成共用电子对,而形成离子键。
(2)同种元素原子间形成的共价键为非极性键,不同种元素原子间形成的共价键为极性键。
(3)通过物质的结构式,可以快速有效地判断键的种类及数目;判断成键方式时,需掌握:共价单键全为σ键,共价双键中有一个σ键和一个π键,共价三键中有一个σ键和两个π键。
5.键参数
(1)概念

(2)键参数对分子性质的影响
①键能越大,键长越短,分子越稳定。
②

【归纳总结】比较键角大小的三种思维模型
(1)杂化轨道类型不同:sp>sp2>sp3。
(2)

(3)在同一分子中,π键电子斥力大,键角大。
四、分子结构与性质
1.与分子结构有关的两种理论
(1)杂化轨道理论
①基本观点:杂化轨道成键满足原子轨道最大重叠原理;杂化轨道形成的共价键更加牢固。
②杂化轨道类型与分子立体构型的关系
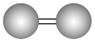
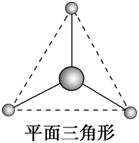
杂化轨道类型 | 杂化轨道数目 | 分子立体构型 | 实例 |
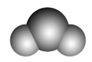
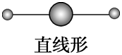
sp | 2 | 直线形 | CO2、BeCl2、HgCl2 |
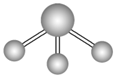
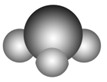
sp2 | 3 | 平面三角形 | BF3、BCl3、CH2O |
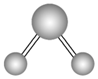
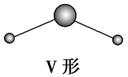
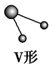
V形 | SO2、SnBr2 | ||
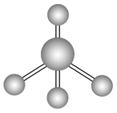
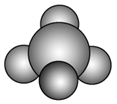
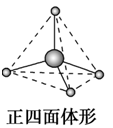
sp3 | 4 | 四面体形 | CH4、CCl4、CH3Cl |
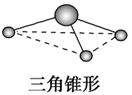
三角锥形 | NH3、PH3、NF3 | ||
V形 | H2S、H2O |
注意:杂化轨道数=与中心原子结合的原子数+中心原子的孤电子对数。
(2)价层电子对互斥理论
①基本观点:分子的中心原子上的价层电子对(包括σ键电子对和中心原子上的孤电子对)由于相互排斥,尽可能趋向彼此远离。
②价层电子对数的计算
中心原子的价层电子对数=σ键电子对数(与中心原子结合的原子数)+中心原子的孤电子对数=σ键电子对数+1/2 (a-xb)
其中a为中心原子的价电子数,x、b分别为与中心原子结合的原子数及与中心原子结合的原子最多能接受的电子数(H为1,其他原子为“8-该原子的价电子数”)。微粒为阳离子时,中心原子的价电子数要减去离子所带电荷数;微粒为阴离子时,中心原子的价电子数要加上离子所带电荷数。如SO2中硫原子的孤电子对数为 (6-2×2)/2=1;H3O+中氧原子的孤电子对数为(6-1-3×1)=1;CO32-中碳原子的孤电子对数为(4+2-3×2)/2=0。
【易错提醒】在计算孤电子对数时,出现0.5或1.5,则把小数进位为整数,即1或2。如NO2的中心原子N的孤电子对数为(5-2×2)/2=0.5≈1,则价层电子对数为3,故VSEPR模型为平面三角形,分子立体构型为V形。
③利用价层电子对互斥理论判断分子(或离子)立体构型
价层电子对数 | 孤电子对数 | 分子(或离子)立体构型 | 示例 |
2 | 0 |
| CO2、BeCl2 |
3 | 0 |
| BF3、SO3、CO32- |
3 | 1 |
| SO2 |
4 | 0 |
| CH4、NH4+、SO42-、CCl4 |
4 | 1 |
| NH3、PCl3、H3O+ |
4 | 2 |
| H2O、H2S |
2、判断杂化轨道类型的一般方法
(1)看中心原子有没有形成双键或叁键,如果有1个叁键,则其中有2个π键,是sp杂化;如果有1个双键,则其中有1个π键,是sp2杂化;如果全部是单键,则是sp3杂化。
(2)杂化轨道数等于中心原子的孤对电子对数与相连的其他原子个数之和。若和为2,则中心原子sp杂化;若和为3,则中心原子sp2杂化;若和为4,则中心原子sp3杂化。如NH3,N原子有1对孤电子对,另外与3个氢原子成键,所以为1+3=4,为sp3杂化;再如CO2,C原子没有孤电子对,与2个氧原子成键,所以为0+2=2,为sp杂化。
3、中心原子A的价层电子对数的计算方法:
对ABm型化合物,中心原子A的价层电子对数n=(A的价电子数+B提供的电子数×m)/2,计算时一般说来,价电子数即为最外层电子数,但B为卤素原子、氢原子时,提供1个价电子,若为氧原子、硫原子时,则不提供电子。
4、等电子体的判断方法
(1)判断方法:一是同主族变换法,如CO2与CS2、CF4与CCl4是等电子体,二是左右移位法,如N2与CO,CO32-、NO3-与SO3是等电子体。如果是阴离子,价电子应加上阴离子所带的电荷数;如果是阳离子,价电子应减去阳离子所带的电荷数。如NH价电子为8,CO32-价电子为24。
(2)常见的等电子体
微粒 | 通式 | 价电子总数 | 立体构型 |
CH4、NH4+ | AX4 | 8e- | 正四面体形 |
CO、N2 | AX | 10e- | 直线形 |
CO2、CNS-、NO2-、N3- | AX2 | 16e- | 直线形 |
SO2、O3、NO2- | AX2 | 18e- | V形 |
CO32-、NO3-、SO3 | AX3 | 24e- | 平面三角形 |
PO33-、SO32-、ClO3 | AX3 | 26e- | 三角锥形 |
SO42-、PO43- | AX4 | 32e- | 正四面体形 |
5、分子性质
(1)分子极性
1)分子构型与分子极性的关系
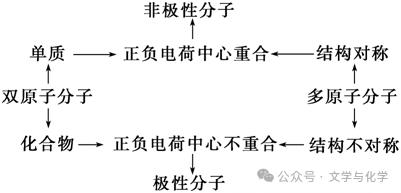
2)键的极性与分子极性的关系
类型 | 实例 | 两个键之间的夹角 | 键的极性 | 分子的极性 | 空间构型 |
X2 | H2、N2 | - | 非极性键 | 非极性分子 | 直线型 |
XY | HCl、NO | - | 极性键 | 极性分子 | 直线型 |
XY2(X2Y) | CO2、CS2 | 180° | 极性键 | 非极性分子 | 直线型 |
SO2 | 120° | 极性键 | 极性分子 | 三角形 | |
H2O、H2S | 104.5° | 极性键 | 极性分子 | V形 | |
XY3 | BF3 | 120° | 极性键 | 非极性分子 | 平面三角形 |
NH3 | 107.3° | 极性键 | 非极性分子 | 三角锥形 | |
XY4 | CH4、CCl4 | 109.5° | 极性键 | 非极性分子 | 正四面体 |
(2)溶解性——“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂;若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
(3)无机含氧酸分子的酸性
无机含氧酸可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,使R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如酸性:HClO<HClO2<HClO3<HClO4。
6.配合物
(1)孤电子对
分子或离子中没有跟其他原子共用的电子对称孤电子对。
(2)配位键
①配位键的形成:成键原子一方提供孤电子对,另一方提供空轨道形成共价键。
②配位键的表示:常用“―→”来表示配位键,箭头指向接受孤电子对的原子,如NH4+可表示为
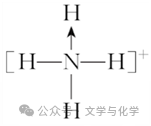
,在NH4+中,虽然有一个N—H键形成过程与其他3个N—H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
(3)配合物。如[Cu(NH3)4]SO4
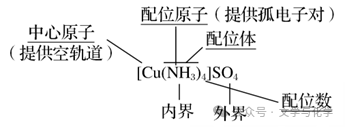
配位体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等。中心原子有空轨道,如Fe3+、Cu2+、Zn2+、Ag+等。
五、晶体结构与性质
1、晶体类型的判断
(1)依据物质的分类判断
金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金是金属晶体。
(2)依据组成晶体的晶格质点和质点间的作用判断
离子晶体的晶格质点是阴、阳离子,质点间的作用是离子键;原子晶体的晶格质点是原子,质点间的作用是共价键;分子晶体的晶格质点是分子,质点间的作用为分子间作用力;金属晶体的晶格质点是金属离子和自由电子,质点间的作用是金属键。
(3)晶体的熔点判断
离子晶体的熔点较高,常在数百度至一千余度;原子晶体熔点高,常在一千度至几千度;分子晶体熔点低,常在数百度以下至很低温度;金属晶体多数熔点高,但也有相当低的。
(4 )依据导电性判断
离子晶体水溶液及熔化时能导电;原子晶体一般为非导体,但有些能导电,如晶体硅;分子晶体为非导体,而分子晶体中的电解质(如酸和部分非金属气态氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电;金属晶体是电的良导体。
(5)依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;原子晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有较低的,且具有延展性。
2、均摊法确定晶胞组成
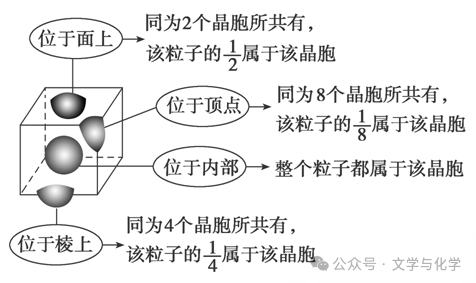
(1)方法:晶胞中任意位置上的一个原子如果是被n个晶胞所共有,那么,每个原子对这个晶胞的贡献就是1/n。
(2)类型
①长方体(正方体)晶胞中不同位置的粒子对晶胞的贡献:
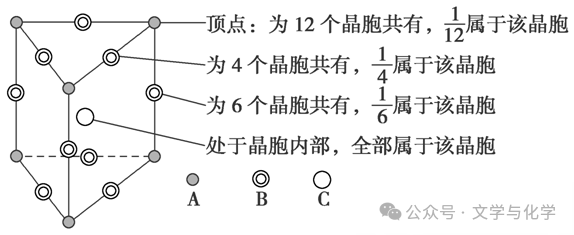
②非长方体(非正方体)晶胞中粒子对晶胞的贡献视具体情况而定。如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为1/3。在如图所示的正三棱柱形晶胞中:
③熟记几种常见的晶胞结构及晶胞含有的粒子数目。
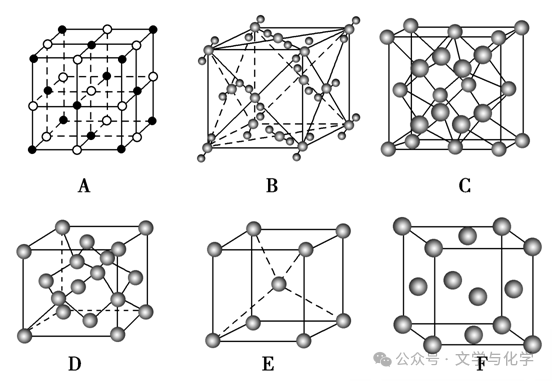
A.NaCl(含4个Na+,4个Cl-)
B.干冰(含4个CO2)
C.CaF2(含4个Ca2+,8个F-)
D.金刚石(含8个C)
E.体心立方(含2个原子)
F.面心立方(含4个原子)

 (图文来源网络,版权归原作所有)
(图文来源网络,版权归原作所有)
欢迎你关注《文学与化学》公众平台

长按二识别维码
《文学与化学》
经典链接分享:
原创:贾身爽||过客
居安不思危,提醒你们唱《国歌》:中华民族到了最危险的时候
原创:刘廷炎||神垕 白峪鈞窑遗址的前世今生
原创:邓黎明||2018年高考作文|致2035年某先生书
心静如水||又是江南烟雨时
蒋介石病逝后,大陆是怎么报道的?看后令人心酸
漆定春||吴龙女:和坪田割不断的血脉亲情
漆定春||是谁触动了婚姻生活的平行线
北石||岁未、许你一段暖香
贾身爽||进山城
陈奠华||我的母亲
徐银秋||中华奇女 :名声遗臭万年,诗作流芳千古 徐银秋
《文学与化学》
创文学之巅峰!造化学之摇篮!
《文学与化学》微信公众平台
征稿启事
《文学与化学》综合微信公众平台,创刊以来,平台获得了广大文学爱好者的认可,发展迅速,读者群体不断壮大,覆盖文学圈及社会各界人士,为了适应不同读者群体的阅读需求,将对微信公众平台栏目设置进行调整,增加小说、散文、剧本、书画艺术的比重。现面向社会征稿。具体如下:
一.文体不限
例如:
1、小说。
2、剧本。
3、散文、文学评论、游记与随笔。
4、现代诗歌。
5、古体诗词。
6、传记。
7、少儿文学。
8、杂文。
9、幽默与笑话。
10、回顾经典。
二.征稿要求:
1、投稿必须先关注《文学与化学》微信公众号,并留个人微信。
2、每次投稿1-2篇,字数不限。
不得含有色情和暴力等违反法律法规的内容。
3、投稿作者附200字以内简介,个人照片一张,电话、微信等联系方式。
4、各栏目根据需要开通读者留言与打赏功能。
5、本平台属于创立阶段,平台没有稿酬。
文章自公布日起,五天内单个赞赏金超过20元的(不累积计算),拿单个赞赏费的80%回报作者。
文章自公布日起,五天内留言超过500人或点赞超过1000或阅读量超过1500人的平台给予30元奖励,五天内留言超1000人或点赞超过2000或阅读量超过3000人的给予60元奖励。
五天之后,由于平台无法统计,不计算。
红包发出24小时后不领取,视为放弃!
6、新作旧作均可,但必须是原创作品,没有在其他公众号上发表过。拒绝抄袭,文责自负。
7、本平台,不向作者收取任何费用。
8、投稿采用周期一般在一个月左右,投稿后请耐心等待,勿一再催问。人力有限,未采用的稿件恕不一一回复。
9、投稿即视为接受本平台规则。请详细阅读说明后再投稿。
10、请你添加微信:d13787543086,能成为好友。
你的支持是我最大的幸福!
11、从2018年3月1日起实施以下新规则:
文章自公布日起,五天内单个赞赏金超过20元的(不累积计算),拿单个赞赏费的80%回报作者,五天内总赞赏金超过100元的,拿总赞赏费的50%回报作者,两种不重复计算,就高不就低。
文章自公布日起,五天内留言超过200条,或点赞超过500或阅读量超过1000人的平台给予30元奖励,五天内留言超500人或点赞超过1000或阅读量超过2000人的给予60元奖励。
五天之后,由于平台无法统计,不计算。
红包发出24小时后不领取,视为放弃!
三.投稿方式
投稿邮箱:1834136305@qq.com
或duan67@163.com
加为好友后,也可微信投稿,微信:d13787543086。
须在邮件标题中注明投稿字样。
有问题可在公众号留言咨询,或加微信咨询。
投稿请先用微信扫二维码,关注公众号!

长按实现关注
《文学与化学》微信公众平台
2018年元月26日