类型1:物质性质的验证实验
1.硫在空气和氧气中的燃烧(教材上册P33)
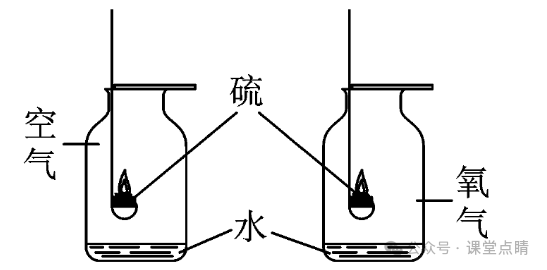
(1)如图所示,硫在空气中燃烧的现象是产生淡蓝色火焰,在氧气中燃烧的现
象是产生蓝紫色火焰,比较硫在空气和氧气中的燃烧现象,说明氧气的浓
度越大,燃烧越剧烈。

(2)集气瓶内预先放入少量水的目的是吸收SO2,防止污染空气,也可以用
NaOH溶液代替水达到相同的目的。
2.木炭在空气和氧气中的燃烧(教材上册P46)
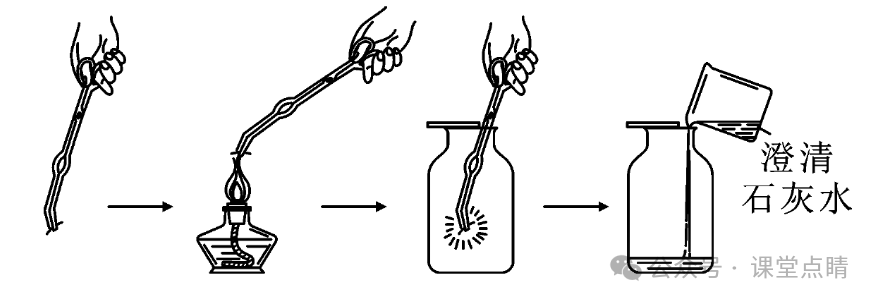
(1)如图所示,用坩埚钳夹取一小块木炭,在酒精灯上加热到发红,由瓶口向下缓慢插到一瓶充满氧气的集气瓶中,观察到的现象为发出白光。
(2)燃烧停止后,取出坩埚钳,向集气瓶中加入少量澄清石灰水,振荡,观察到的
现象为澄清石灰水变浑浊。
3.铁丝在空气和氧气中的燃烧(教材上册P34)
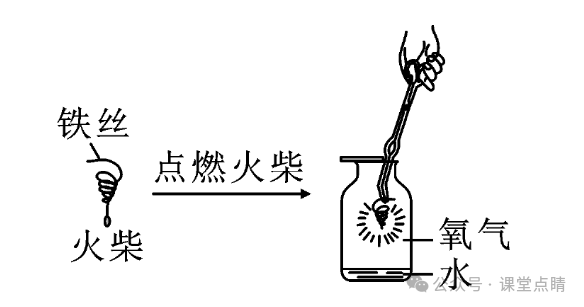
(1)如图所示,将一根光亮的细铁丝盘成螺旋状,在下端系一根火柴,点燃火柴,待火柴快燃尽时,插人盛有氧气的集气瓶中,集气瓶内预先放少量水,此时观察到的实验现象是铁丝剧烈燃烧,火星四射,生成黑色固体。
(2)集气瓶内水的作用是防止高温熔融物溅落下来炸裂瓶底,若用细沙代替水,也可以起到相同的作用。
(3)将一根光亮的细铁丝盘成螺旋状,直接放在酒精灯上烧至红热,结合铁丝在氧气中燃烧的现象,说明细铁丝不能在空气中燃烧。
4.二氧化碳的性质实验(教材上册P117~P118)
(1)如图所示,将二氧化碳沿容器内壁缓缓倒入,发现下层蜡烛先熄灭,上层蜡
烛后熄灭。说明二氧化碳具有的物理性质是密度比空气大,化学性质是不能燃烧,也不能支持燃烧。
(2)二氧化碳的溶解性实验。
①向一个收集满二氧化碳气体的质地较软的塑料瓶中加人约一体积的水,立即旋紧瓶塞,振荡,观察到软塑料瓶变瘪,产生该现象的原因是二氧化碳能溶于水,使瓶内气压减小,大气压作用所致。
②振荡塑料瓶的目的是使二氧化碳充分溶解在水中(或与水反应)
③将瓶中气体换成氨气能观察到同样的现象。
(3)二氧化碳与水的反应。
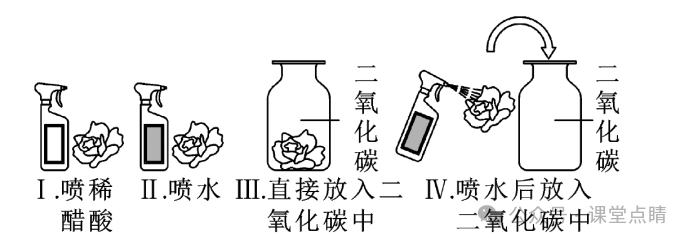
如图所示,取四朵用紫色石蕊溶液浸泡并干燥后的纸花依次进行,上述实验。
①观察到实验I、IV 的纸花变红色。
②实验IV中纸花变红的实质是二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊变成红色。
5.比较合金和纯金属的硬度(教材下册P5)
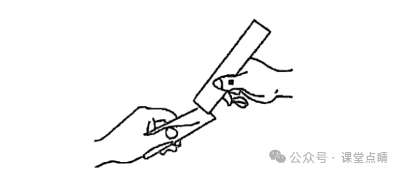
将纯铜片和黄铜(铜锌合金)片相互刻画,有较明显划痕的是纯铜片,说明纯金属的硬度较小,由此可知,与纯金属相比,合金的硬度更大
6.酸、碱的化学性质(教材下册P69)
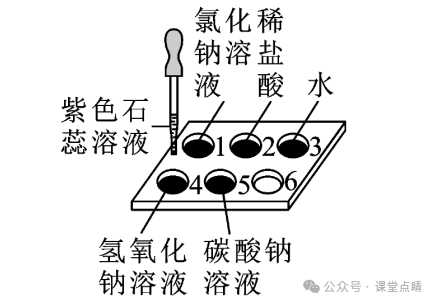
如图所示,在白色点滴板1~5的孔穴中分别滴加2滴紫色石蕊溶液。
(1)可观察到孔穴2中溶液变红。
(2)孔穴3中水的作用是作空白对比。
(3)选用紫色石蕊溶液而不用酚酞溶液的原因是紫色石蕊遇酸性溶液变成红色,遇碱性溶液变成蓝色,遇中性溶液不变色,
(4)孔穴5中碳酸钠溶液变蓝,说明碳酸钠溶液呈碱性。
7.浓硫酸的腐蚀性(教材下册P53)
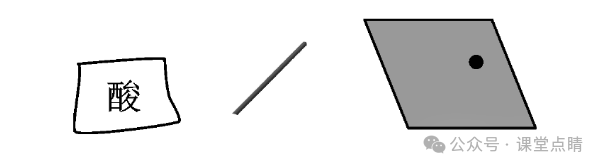
(1)用玻璃棒蘸取浓硫酸在纸上写字,放置一会儿,观察到的现象为纸上有字的部分变黑。
(2)用小木棍蘸取少量浓硫酸,放置一会儿,观察到的现象为小木棍蘸有浓硫
酸的部分变黑。
(3)将浓硫酸滴到一小块布上,放置一会儿,观察到的现象为布上滴有浓硫酸的部分由黄变黑,并出现破洞。
8.碱的化学性质(教材下册P56)
(1)将无色酚酞溶液滴入氢氧化钠或氢氧化钙溶液中,溶液显红色。
(2)氢氧化钠不仅会吸收空气中的水分而潮解,还会吸收CO2(或二氧化碳)而
变质,变质的化学方程式为CO2十2NaOH= Na2CO3+ H2O,所以氢氧化钠必须密封保存
9.酸碱中和反应(教材下册P6O)
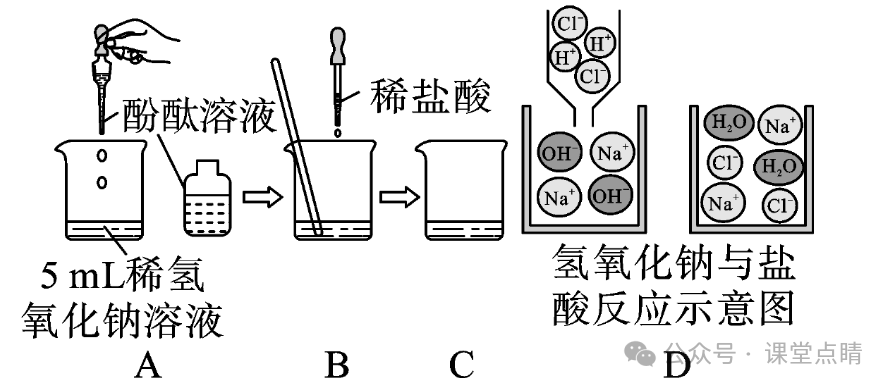
如图A,向5mL稀氢氧化钠溶液中加入无色酚酞溶液后,观察到的现象是溶液变红;
如图B,再往烧杯中加人稀盐酸观察到红色逐渐消失,产生此现象的原因是稀盐酸和氢氧化钠反应,溶液逐渐变为中性,酚酞褪为无色。图D反映的是中和反应的实质,酸和碱反应实际上是H++OH-=H2O。
10.碳酸钠、碳酸氢钠的性质实验(教材下册P74 )
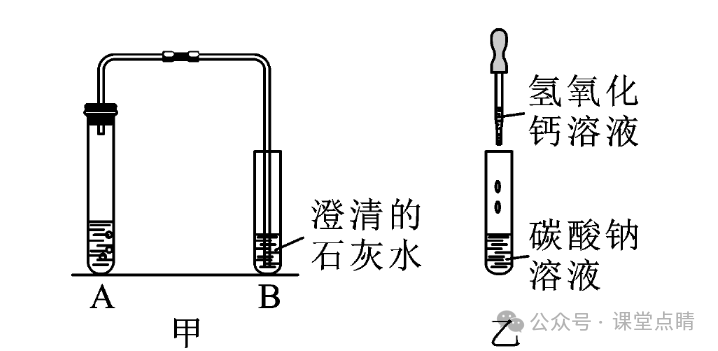
(1)图甲试管A中是碳酸钠溶液与稀盐酸,可观察到的现象是有气泡产生,发生反应的化学方程式为Na2CO3十2HCl=2NaCl+ H2O+CO2↑,试管B中可观察到的现象是澄清石灰水变浑浊,发生反应的化学方程式为
CO2 +Ca(OH)2 =CaCO3↓十H2O。
(2)若将图甲试管A中的碳酸钠溶液换成碳酸氢钠溶液,则试管A中发生反应的化学方程式为NaHCO3+ HCl=NaCl+ H2O+CO2↑。
(3)图乙中可观察到的实验现象为有白色沉淀产生。
(4)实验室鉴别碳酸氢钠固体与碳酸钠固体常用的方法为加热,能分解产生使澄清石灰水变浑浊气体的固体是NaHCO3,无变化的是Na2CO3 。






