 中考化学解题思路大集合
中考化学解题思路大集合
一、各题型答题技巧及注意事项
1、选择题:
(1)为了避免出现“明明想的是A,却写了B”或者“涂答题卡时涂错”等类似的情况发生,可按照以下步骤进行:先勾选项前的字母,再在括号里填上已选字母,涂卡时核对无误后填涂,即可避免上述情况的发生;
(2)务必看清楚“正确的是”、“不正确的是”、“错误的是”等题干要求;
(3)遇到不会的题,先排除有把握的选型,再圈题号,回头检查时再做一遍;
(4)选择填充题的D选项,模仿正确选项或者修改错误选项。
2、填空题
(1)化学用语包括:化学式,离子符号,元素符号,化合价。看清楚“名称”和“化学用语”;
(2)填写比例时不化简也可以,看清楚“元素质量比”和“分子个数比”或“原子个数比”。
3、实验探究题(建议最后写)
(1)先弄清楚实验探究的目的,即“对象”是什么;
(2)做题三步走:一步30秒通读全文,二步填写答案(不会的跳过),三步回头看资料,把空着的填上,从头到尾顺一遍(三步走完依然有不会填的就过,最后全部做完时再来填写,千万别空着);
4、计算题
关键在于找到正确的化学反应方程式,以及物质对应的质量(只能带入纯净物的质量进行计算),中考计算题的数字往往很容易计算,若再考试过程中发现很难算,请按照以下步骤检查:①查看方程式是否正确(化学式、配平、箭头、条件)②相对分子质量是否正确(很容易漏掉乘以化学式前面的系数)③是否忘记乘以浓度或者质量分数
几种常见的问题:
(1)求样品中A的质量分数=(A的质量)/(样品的质量);
(2)求溶液中溶质的质量分数=(溶质的质量)/(溶液总质量-沉淀-气体),注意,溶液总质量即为加入烧杯中物质的总质量;
(3)表格类的题目一定弄清楚“一个烧杯”和“几个相等的烧杯”
二、各个知识点答题技巧
1、判断元素化合价
被判断元素不能用口诀,其余元素使用口诀,遇到原子团时将其看作整体更方便。
2、图像类(“三点”:起点、拐点、终点;“二坐标”:横纵坐标的意义)
(1)“反应时间”是指化学反应已经开始了,“加热时间”化学反应往往还没开始,要预热一段时间,反映在图像中会有一段“空白”;
(2)纵坐标为pH值时,看准烧杯中的物质,若为酸性,起点小于7;
(3)溶质的质量:溶于水的那部分溶质才能计算质量,未溶解和沉淀的都不算;
(4)溶液的质量:减掉“沉淀”和“气体”;
(5)多种物质混合时的反应顺序:有酸或碱参与的反应优先,最强的金属与最弱的先。
3、陌生化学方程式的书写
(1)反应条件:题干中给什么就写什么,不要怀疑对错;
(2)生成物或者反应物的推测原则:根据元素守恒推测,通常为常见的化学式;
(3)若是按照复分解反应的规则书写时,注意要满足其发生条件:沉淀、气体、水。
4、物质鉴别
有不同现象即可,现象包括:颜色、沉淀、气体、固体溶解。
5、除杂
两个原则:不可除去主题物质,不可引入新的杂质;可燃性气体除杂时不可点燃。
6、溶解度曲线
(1)物质的溶解度只有在注明温度下才有意义;
(2)“提纯”或“得到”某物质,对应的方法为①降温结晶(上升线)②蒸发结晶(水平线);
(3)物质溶于水吸放热现象:①升温:氢氧化钠、浓硫酸、氧化钙②降温:硝酸铵;
(4)比较晶体析出质量大小时,只有在“溶液质量相等且饱和”的条件下才可比(上课常说的“一杯水”、“一桶水”);
(5)饱和溶液降温时,溶质质量分数的变化:上升线坐滑梯,下降线平移。
7、流程图
(1)操作名称:过滤、蒸发(玻璃棒的作用);(2)可回收的物质:看箭头进出;(3)研磨、粉碎的作用:增大反应物的接触面积(4)“过量”、“足量”的目的是:保证、除尽某物质,或使反应充分(反应后固体、溶液成分)
8、推断题(推完之后再走一遍)
(1)五种物质类别:单质(H2、O2、C、Fe、Cu)、氧化物(CO、CO2、H2O、H2O2、Fe2O3、CuO、CaO)、酸(HCl、H2SO4、H2CO3)、碱(NaOH、Ca(OH)2)、盐(Na2CO3、CaCO3、CuSO4、FeSO4、NaHCO3);
 (2)涉及到高温的反应:①冶炼金属:具有还原性的物质CO、C、H2;②煅烧石灰石;③联系C、CO、CO2的反应:C + CO2 = 2CO;
(2)涉及到高温的反应:①冶炼金属:具有还原性的物质CO、C、H2;②煅烧石灰石;③联系C、CO、CO2的反应:C + CO2 = 2CO;
(3)特别关注“1变2”的箭头:
①过氧化氢分解②碳酸钙分解③碳酸钠生成水和CO2④水电解⑤碳酸分解
(4)连线最多的常为酸或水;
(5)回忆酸碱盐的性质:①酸:与活泼金属、与金属氧化物、与碱、与盐;②碱:与非金属氧化物、与酸、与盐;③盐:与酸、与碱、与盐;
(6)回忆金属的性质:与氧气、与酸、与盐。
(7)四大基本反应类型:化、分、置、复(CO2与碱的反应不是复分解反应,CO冶炼金属也不是置换反应)。
9、第21题:注意看准“制取装置”、“发生装置”、“收集装置”。
10、气球变大
(1)产生气体:生成H2、O2、CO2;(2)温度升高:反应放热或者物质溶于水放热。
11、气球变小
(1)吸收气体:氢氧化钠溶液吸收CO2,铁生锈消耗O2;(2)温度降低:碳酸铵溶解吸热。
12、温度升高
物理变化 | 化学变化 |
氢氧化钠溶解 | 酸碱中和 |
浓硫酸稀释 | 氧化钙与水 |
摩擦生热 | 碳酸钙与稀盐酸 |
| 锌与稀硫酸 |
13、温度降低:硝酸铵溶解,加冰水(物理变化)。
14、放置在空气中变质
考虑空气中能反应的成分:O2、CO2、H2O
物理变化 | 化学变化 | |||
铜生锈 | O2、H2O、CO2 | 质量增加 | ||
挥发性 (质量减小) | 浓盐酸 | 铁生锈 | O2、H2O | |
浓氨水 | 氢氧化钠 | CO2 | ||
酒精 | 氢氧化钙 | CO2 | ||
吸水性 (质量增加) | 氢氧化钠 | 碱石灰(NaOH、CaO) | H2O、CO2 | |
浓硫酸 | CaO | H2O | ||
15、金属类题目(先排序,再做题)
(1)反应顺序:活动性最强的与最弱的先反应;
(2)生成等质量的氢气,消耗金属的质量:相对原子质量越大,消耗的质量越多。
16、描述现象
固体 | 固体完全消失、固体部分消失、有固体析出、颜色变化 |
液体 | 溶液变浑浊、产生沉淀、颜色变化 |
气体 | 产生气泡 |
17、书写操作步骤:取样→加入某种试剂→观察现象
18、化学方程式的配平:单质最后配(先在单质前面配上分数,然后两边同时乘以相同的倍数去分母)
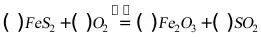
19、微观反应过程:先“约分”,再配平。






