概率预测 | ☆☆☆☆☆ |
题型预测 | 选择题☆☆☆☆☆ |
考向预测 | ①化学反应热、化学反应速率有关的反应历程是考查的重点。 ②单循环和多循环的催化机理是考查的重点。 |
秘籍
反应历程或机理图像一般取材于实际科研成果,充分体现了化学反应的本质,高考常以此为载体考查反应原理、活化能、反应热等知识,是近年高考的命题热点,此类试题难点是从陌生图像中提取解题信息。反应的历程能够反映出物质结构和反应能力之间的关系,从而可以加深我们对于物质运动形态的认识。反应机理是化学中用来描述某一化学变化所经由的全部基元反应,机理详细描述了每一步转化的过程,包括过渡态的形成,键的断裂和生成,以及各步的相对速率大小等。化学反应机理试题以图示的形式来描述某一化学变化所经由的全部反应,就是把一个复杂反应分解成若干个反应,然后按照一定规律组合起来,从而达到阐述复杂反应的内在联系的目的。解答时注意题干信息的理解应用,通过分析化学反应过程,明确反应过程中催化剂的作用和能量变化、化学键的变化试题常以图像为载体,以陌生的反应历程方程式或示意图为主要信息源,高起点(题目陌生度高,往往用词新颖) ,低落点(考查的思维简单) ,从微观视角来考查反应机理,考查点集中在题目信息采集处理、能量、速率、平衡、结构、反应等关键考点。
知识必备
一、概念
1.反应历程:
反应历程是指化学反应中的反应物转化为最终产物通过的途径,因为化学变化从根本上来说,就是旧键的破裂和新键的生成。反应的历程能够反映出物质结构和反应能力之间的关系,从而可以加深我们对于物质运动形态的认识。
在化学反应中,反应物分子不断发生碰撞,大多数碰撞无法发生反应,只有少数分子的碰撞才能发生化学反应,能发生有效碰撞的分子是活化分子。普通反应物分子形成活化分子所需要的能量叫活化能。而活化分子的碰撞也不一定都能发生有效碰撞。发生有效碰撞不仅有能量的因素,还有空间因素,只有同时满足这两者的要求才能发生有效碰撞。
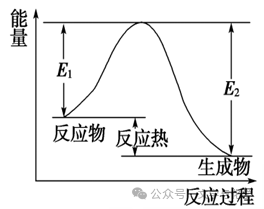
发生有效碰撞的分子叫做活化分子,活化分子具有较高的能量。活化分子比普通分子所高出的能量称为活化能。活化能越小,普通分子就越容易变成活化分子。如图所示,反应的活化能是E1,反应热是E1-E2。
在一定条件下,活化分子所占的百分数是固定不变的。活化分子的百分数越大,单位体积内活化分子数越多,单位时间内有效碰撞的次数越多,化学反应速率越快。活化能越大,反应速率越慢,化学反应取决于最慢的一步。
2.反应机理:
(1)反应机理是用来描述某反应物到反应产物所经由的全部基元反应,就是把一个复杂反应分解成若干个基元反应,以图示的形式来描述某一化学变化所经由的全部反应,然后按照一定规律组合起来,从而阐述复杂反应的内在联系,以及总反应与基元反应内在联系。
(2)反应机理详细描述了每一步转化的过程,包括过渡态的形成,键的断裂和生成,以及各步的相对速率大小等。典型的是基元反应碰撞理论和基元反应过渡态理论。
(3)反应机理中包含的基元反应是单分子反应或双分子反应。完整的反应机理需要考虑到反应物、催化剂、反应的立体化学、产物以及各物质的用量。
(4)认识化学反应机理,任何化合物的每一步反应都应该是在该条件下此类化合物的通用反应。
二、必备基础知识
1.认识反应热的“两个角度”和“三种计算方法”
化学反 应中能 量变化 图示 |
| |
图像 分析 | 微观角度 | 宏观角度 |
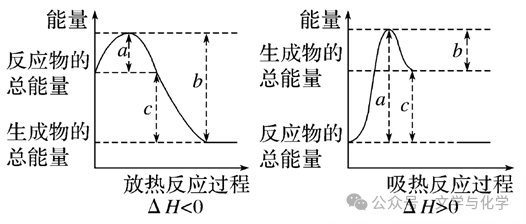
a表示断裂旧化学键吸收的能量; b表示生成新化学键放出的能量; c表示反应热 | a表示反应物的活化能; b表示活化分子形成生成物释放的能量; c表示反应热 | |
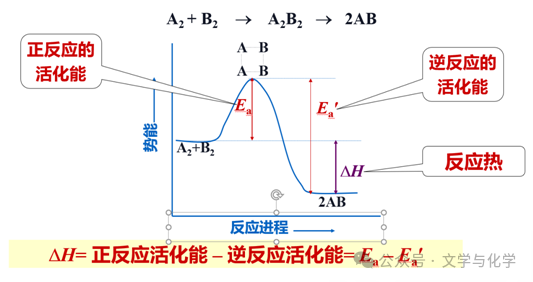
ΔH的 计算 | ①根据反应物和生成物的焓值计算:ΔH=H(生成物)-H(反应物) ②根据反应物和生成物的键能计算:ΔH=∑E(反应物键能)-∑E(生成物键能) ③根据正、逆反应的活化能计算:ΔH=Ea1(正反应活化能)-Ea2(逆反应活化能) | |
2.反应热DH与活化能的关系:
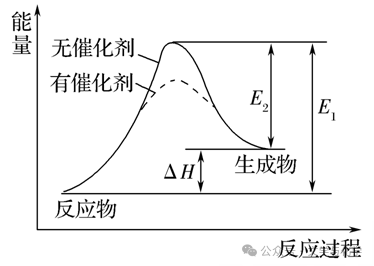
3.正确理解催化剂与活化能、反应热的关系
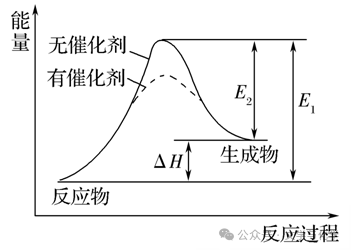
a、催化剂能降低反应所需活化能,但不影响焓变的大小
b、在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即:E1=E2+ΔH
三、基础知识的拓展和应用
1.基元反应、过渡态理论及活化能
(1)基元反应:研究发现,大多数化学反应并不是经过简单碰撞就能完成,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
(2)过渡态理论:过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。这与爬山类似,山的最高点便是过渡态。

2.多步反应的活化能及与速率的关系
(1)多步反应的活化能:一个化学反应由几个基元反应完成,每一个基元反应都经历一个过渡态,及达到该过渡态所需要的活化能(如图E1、E2),而该复合反应的活化能只是由实验测算的表观值,没有实际物理意义。
(2)活化能和速率的关系:基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率就取决于速率最慢的基元反应。

3.催化剂与活化能
(1)催化剂的催化机理:催化剂参与化学反应,生成能量更低的中间产物,降低了达到过渡态所需要的活化能,使反应易于发生,速率加快。这就是我们经常说的催化剂改变反应途径,降低反应的活化能。
(2)催化剂能降低反应所需活化能,化学反应速率加快,但不影响焓变∆H的大小,不影响平衡。
(3)催化反应一般过程(简化的过程):
①反应物扩散到催化剂表面;
②反应物被吸附在催化剂表面;
③被吸附的反应物发生化学反应生成产物;
④产物的解吸。

四、基础知识拓展应用再理解
1.大多数的化学反应不能一步完成,在微观上是分几步完成的,这每一步反应都叫一个基元反应
如:反应H2O2+2Br-+2H+===Br2+2H2O,通过大量实验提出它们微观过程如下:
(1)H++H2O2≒H3O2+
(2)H3O2++Br-===H2O+HOBr
(3)HOBr+H++Br-===H2O+Br2
2.基元反应过渡状态理论
(1)基元反应过渡状态理论认为,基元反应在从反应物到产物的变化过程中要经历一个中间状态,这个状态称为过渡态
AB+C―→[A…B…C]―→A+BC
反应物 过渡态 产物
(2)过渡态是处在反应过程中具有最高能量的一种分子构型,过渡态能量与反应物的平均能量的差值相当于活化能。如:一溴甲烷与NaOH溶液反应的历程可以表示为:
CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
反应物 过渡态 产物
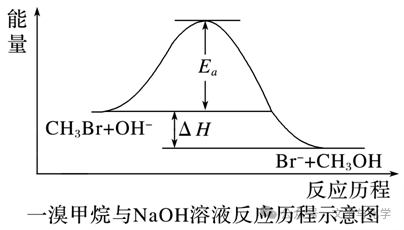
3.正确理解活化能与反应热的关系
a、催化剂能降低反应所需活化能,但不影响焓变的大小
b、在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即:E1=E2+ΔH
4.影响化学反应速率的内因——活化能
(1)相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率快,活化能大的反应速率慢
(2)活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量
(3)化学反应速率与分子间的有效碰撞频率有关,所有能够改变内能、运动速率,以及碰撞几率的方法,都可以用来改变、控制反应的速率,即:活化分子百分数和单位体积活化分子数增大时,化学反应速率也就增大
外界因素 | 活化能 | 分子 总数 | 活化分 子总数 | 活化分子百分数 | 单位体积活化分子数 | 有效碰撞次数 | 反应速率 |
增大反应 物的浓度 | 不变 | 增多 | 增多 | 不变 | 增多 | 增多 | 加快 |
增大反应物的压强 | 不变 | 不变 | 不变 | 不变 | 增多 | 增多 | 加快 |
升高反应 物的温度 | 不变 | 不变 | 增多 | 增多 | 增多 | 增多 | 加快 |
使用催化剂 | 降低 | 不变 | 增多 | 增多 | 增多 | 增多 | 加快 |

 (图文来源网络,版权归原作所有)
(图文来源网络,版权归原作所有)
欢迎你关注《文学与化学》公众平台

长按二识别维码
《文学与化学》
经典链接分享:
原创:贾身爽||过客
居安不思危,提醒你们唱《国歌》:中华民族到了最危险的时候
原创:刘廷炎||神垕 白峪鈞窑遗址的前世今生
原创:邓黎明||2018年高考作文|致2035年某先生书
心静如水||又是江南烟雨时
蒋介石病逝后,大陆是怎么报道的?看后令人心酸
漆定春||吴龙女:和坪田割不断的血脉亲情
漆定春||是谁触动了婚姻生活的平行线
北石||岁未、许你一段暖香
贾身爽||进山城
陈奠华||我的母亲
徐银秋||中华奇女 :名声遗臭万年,诗作流芳千古 徐银秋
《文学与化学》
创文学之巅峰!造化学之摇篮!
《文学与化学》微信公众平台
征稿启事
《文学与化学》综合微信公众平台,创刊以来,平台获得了广大文学爱好者的认可,发展迅速,读者群体不断壮大,覆盖文学圈及社会各界人士,为了适应不同读者群体的阅读需求,将对微信公众平台栏目设置进行调整,增加小说、散文、剧本、书画艺术的比重。现面向社会征稿。具体如下:
一.文体不限
例如:
1、小说。
2、剧本。
3、散文、文学评论、游记与随笔。
4、现代诗歌。
5、古体诗词。
6、传记。
7、少儿文学。
8、杂文。
9、幽默与笑话。
10、回顾经典。
二.征稿要求:
1、投稿必须先关注《文学与化学》微信公众号,并留个人微信。
2、每次投稿1-2篇,字数不限。
不得含有色情和暴力等违反法律法规的内容。
3、投稿作者附200字以内简介,个人照片一张,电话、微信等联系方式。
4、各栏目根据需要开通读者留言与打赏功能。
5、本平台属于创立阶段,平台没有稿酬。
文章自公布日起,五天内单个赞赏金超过20元的(不累积计算),拿单个赞赏费的80%回报作者。
文章自公布日起,五天内留言超过500人或点赞超过1000或阅读量超过1500人的平台给予30元奖励,五天内留言超1000人或点赞超过2000或阅读量超过3000人的给予60元奖励。
五天之后,由于平台无法统计,不计算。
红包发出24小时后不领取,视为放弃!
6、新作旧作均可,但必须是原创作品,没有在其他公众号上发表过。拒绝抄袭,文责自负。
7、本平台,不向作者收取任何费用。
8、投稿采用周期一般在一个月左右,投稿后请耐心等待,勿一再催问。人力有限,未采用的稿件恕不一一回复。
9、投稿即视为接受本平台规则。请详细阅读说明后再投稿。
10、请你添加微信:d13787543086,能成为好友。
你的支持是我最大的幸福!
11、从2018年3月1日起实施以下新规则:
文章自公布日起,五天内单个赞赏金超过20元的(不累积计算),拿单个赞赏费的80%回报作者,五天内总赞赏金超过100元的,拿总赞赏费的50%回报作者,两种不重复计算,就高不就低。
文章自公布日起,五天内留言超过200条,或点赞超过500或阅读量超过1000人的平台给予30元奖励,五天内留言超500人或点赞超过1000或阅读量超过2000人的给予60元奖励。
五天之后,由于平台无法统计,不计算。
红包发出24小时后不领取,视为放弃!
三.投稿方式
投稿邮箱:1834136305@qq.com
或duan67@163.com
加为好友后,也可微信投稿,微信:d13787543086。
须在邮件标题中注明投稿字样。
有问题可在公众号留言咨询,或加微信咨询。
投稿请先用微信扫二维码,关注公众号!

长按实现关注
《文学与化学》微信公众平台
2018年元月26日