
一、海水资源的多重利用
1.制盐工业:通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
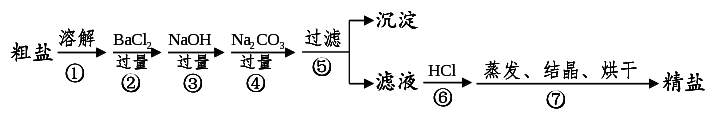
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是 。
(5)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________,理由_____________________________;
(6)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_________ __。
2.金属镁的冶炼
海水中含有丰富的氯化镁。下图是从海水中提取镁的简单流程。
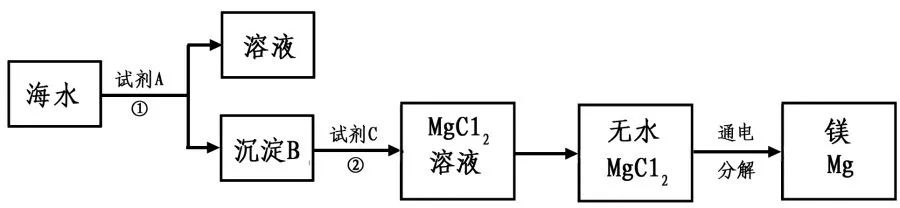
上述提取Mg的过程中,试剂A最好选用 (从我市有丰富的石灰石资源考虑)。沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。电解无水MgCl2的过程中 能转化为 能。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
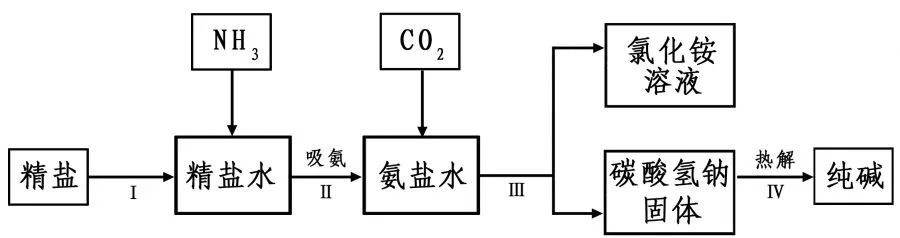
3.氨碱工业
海水“制碱”。下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
 。
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。
已知有关物质重要反应的化学方程式如下:
2NH4Cl+X====2NH3↑+CaCl2+2H2O
NH4Cl=△= NH3↑+HCl↑
根据以上信息回答下列问题。
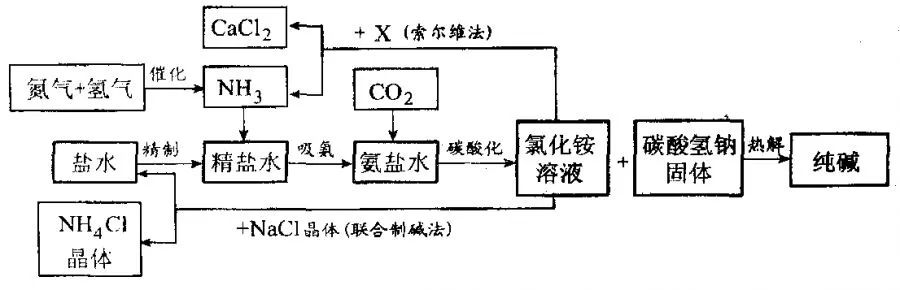
(拓展)
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的Ca2+、Mg2+等沉积,可以向其一和加入过量纯碱.此时将混合液中不溶物除去的方法是 ;溶液中多余的纯碱可以加 试剂来除去。
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:_______________ 。
(3)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化镀溶液中加入物质X (填化学式),产生了可循环使用的氢气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的 ,使氯化铵晶体单独析出得到另一种产品——氮肥.氯化钠溶液则可以循环利用。
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
答: 。
 能源工业(化石燃料的利用、及合成氨工业等)
能源工业(化石燃料的利用、及合成氨工业等)
二、传统能源工业(化工燃料的利用集合成氨工业等)
1、煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。请回答下列问题:
(1)下列说法正确的是 。
A.煤是复杂的混合物,主要含碳元素
B.由煤加工成焦炭发生的是物理变化
C.家用“液化石油气”就是煤隔绝空气加热得到的产品
D.煤燃烧排放的二氧化硫、二氧化氮是形成酸雨的主要物质
(2)煤的加工产品有很多用途,其中焦炭广泛应用于炼铁。
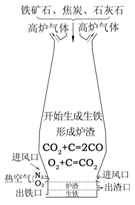
右图是高炉炼铁的示意图。请根据图例回答:
①焦炭在炼铁过程中的主要作用是 ;
②请用化学方程式表示炼铁的原理 ;
③高炉炼铁会产生大量的高炉气体,其主要成分是高浓度的CO和氧化铁尘粒。请你对高炉气体的处理提出合理化的建议 。
(3)化肥厂生产合成氨的原料是煤、空气、水。生产简要流程如下:
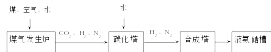
煤气发生炉中主要反应:①C+ O2 = CO2;②C+ H2O = CO + H2。两个反应必须进行调控才能保持一定的炉温。判断:反应② (填“放出”或“吸收”)热量。
将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3,试写出该反应的化学方程式 。
三、石灰石工业
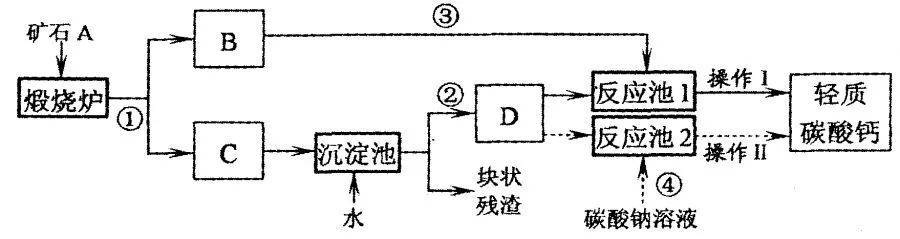
1、用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示。
已知:
a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO2+Ca(OH)2===CaCO3↓+H2O,
CaCO3+H2O +CO2===Ca(HCO3)2;
b.碳酸氢钙微溶于水,微热易分解:
Ca(HCO3)2=微热==CaCO3↓+H2O+CO2↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单。请写出反应①和④的化学方程式:
① ;④ ;
操作Ⅱ包括等工序。
(2)制轻质碳酸钙时,D为 (选填“悬浊液”或“溶液”或“乳浊液”),
理由是: .
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:_______________;操作I包括搅拌和微热等工序。
四、污水处理工业
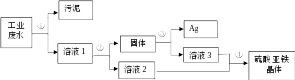
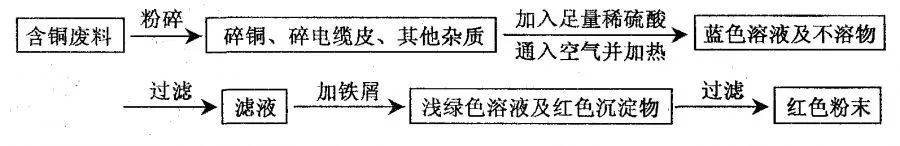
1、有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。方案流程如下:
回答下列问题:
(1)步骤②中:需加入的物质是 ,分离所得混合物的方法是 。
(2)步骤③中:需加入的物质是 ,发生反应的化学方程式是 。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?,理由是 。
(4)步骤④的操作是 ,溶液2和溶液3为什么要混合? .
五、金属回收工业
1、坐落于常熟的江苏常福电缆厂是一家以生产电缆类产品为主的企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.
甲同学根据已学知识,提出了一套回收方案:
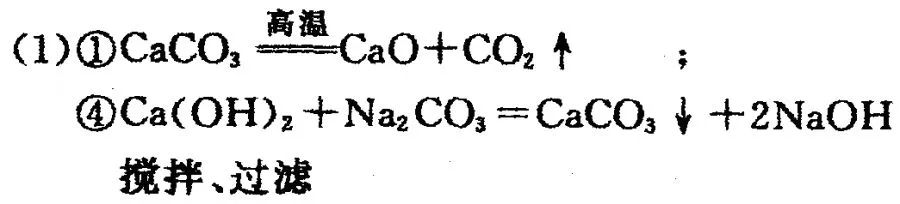
乙同学在查阅资料后得知:在通入空气并加热的务件下,铜可与稀硫酸在溶液中发生反应
(方程式为:2Cu+2H2SO4+O2=△=2CuSO4+2H2O),
于是他提出了另一套方案:
(1)甲方案的②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:② ;③ .
(2)从环保角度对两套方案的不同部分进行比较,你认为 (选“甲”或“乙”)的方案更合理.理由是: .
(3) 丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是: .
丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该用什么化学方法处理?”.请提出你的想法 .
(4) 最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.请写出使“绿矾”结晶的两种可能方法:、 (“绿矾”溶解度随温度升高而增大).
答案
1.制盐工业答案:(1)加快粗盐溶解 (2)Na2SO4 NaOH、Na2CO3 (3)CaCO3、BaCO3
(4)会引进新的杂质KCl(5)不可以。碳酸钠作用是既除去Ca2+,又除去多余的氯化钡
(6)除去多余的氢氧化钠和碳酸钠
2、Mg(OH)2 MgCl2通电Mg+Cl2↑后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
3、NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 2NaHCO3△Na2CO3+ H2O+CO2↑ 氨气溶于水形成碱性溶液,更易于吸收二氧化碳
(拓展)
(1)过滤 盐酸 (2)促进更多CO2溶解反应充分 (3)Ca(OH)2溶解度(4)氯化铵受热易分解
二、传统能源工业
(1)AD
(2)①制取CO、提供热量②Fe2O3+ 3CO-高温-2Fe + 3CO2③回收利用
(3)吸收 CO2 + NH3 + H2O =NH4HCO3
三、石灰石工业

四、污水处理工业
(1)Fe 过滤
(2)稀硫酸 Fe+H2SO4=FeSO4+H2↑
(3)不合理 因为要使Ag+完全置换出来,必须加入过量的铁
(4)两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用(其他合理答案也可)
五、金属回收工业

来 源:初三研究中心 , 我们尊 重原创,如存在文章/图片/音视频使用 不当的情况,或涉及原创内容,侵害了您的权益,请随 时与我们联系,联系(QQ):504580314。2024广东中考大考卷化学热卖中 点击图片立即购买 ↓↓↓
点击阅读原文,立即购买2024广东中考大考卷! ↓↓↓







