高考难点突破:分布系数图及溶液中粒子浓度关系

一、透析分布曲线 奠定思维方向
分布系数是指一定型体的平衡浓度占相关型体浓度之和的百分比,称为分布分数又称分布系数。分布系数决定于该酸碱物质的性质和溶液的酸度,而与其总浓度(又称分析浓
度)无关,各种型体的分布系数之和为1。
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
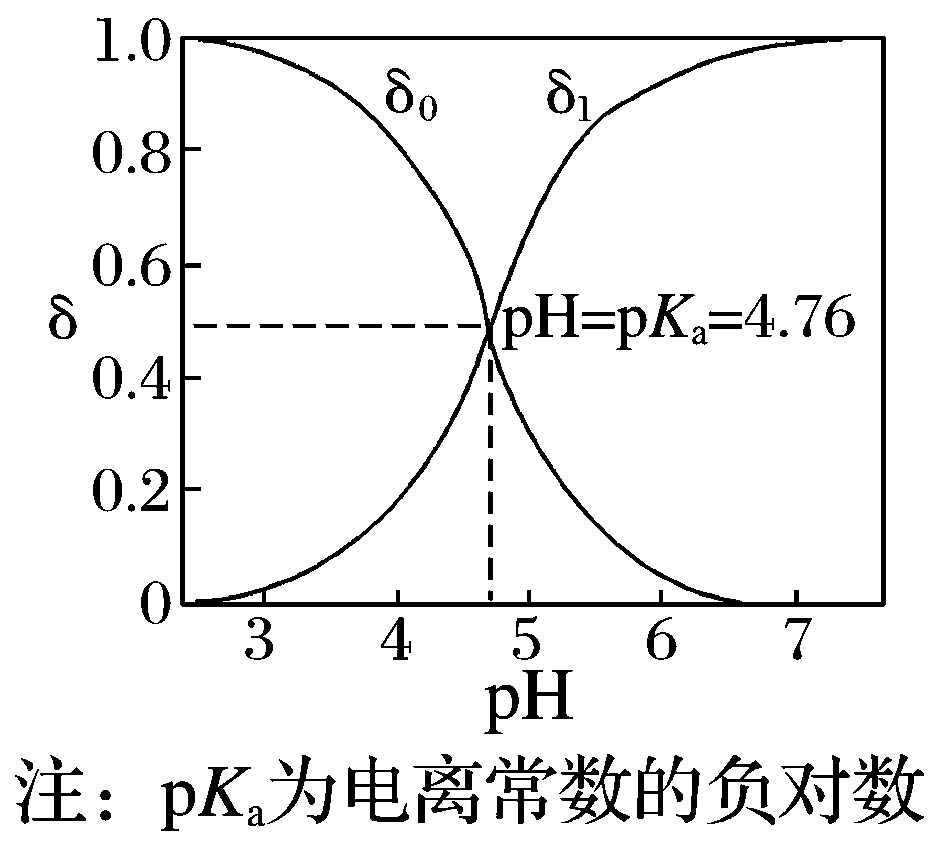
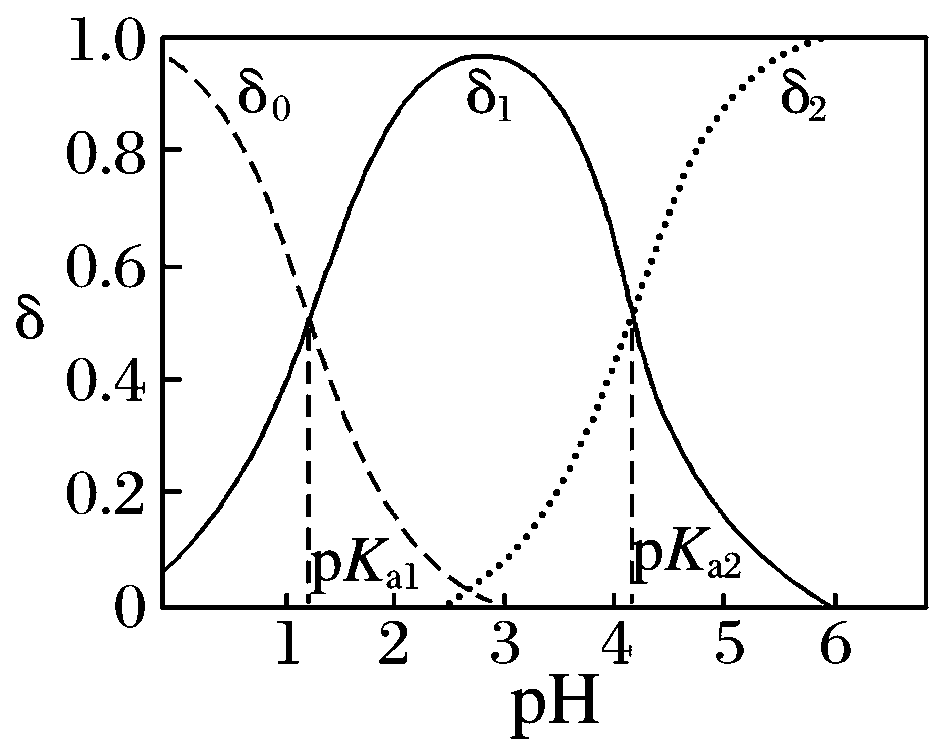
一元弱酸(以CH3COOH为例) | 二元酸(以草酸H2C2O4为例) |
|
|
δ0为CH3COOH分布系数,δ1为 CH3COO-分布系数 | δ0为H2C2O4分布系数、δ1为HC2O4-分布系数、δ2为C2O42-分布系数 |
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布系数可以书写一定pH时所发生反应的离子方程式 | |
同一pH条件下可以存在多种溶质微粒。根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH时的平衡浓度 | |
二、熟悉两大理论 构建思维基点
1.电离平衡→建立电离过程是微弱的意识
弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力。如在稀醋酸溶液中:CH3COOH⇌CH3COO-+H+,H2O⇌OH-+H+,在溶液中,粒子浓度由大到小的顺序:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)。
2.水解平衡→建立水解过程是微弱的意识
弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。
如稀的CH3COONa溶液中,CH3COONa===CH3COO-+Na+,CH3COO-+H2O ⇌ CH3COOH+OH-,H2O ⇌ H++OH-,溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。
三、把握三大守恒 明确定量关系
1.电荷守恒
在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性。
2.物料守恒(原子守恒)
在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变,符合原子守恒。
3.质子守恒
在水溶液中由水电离出的H+和OH-总数相等。
四、抓准五个关键点 形成思维模型
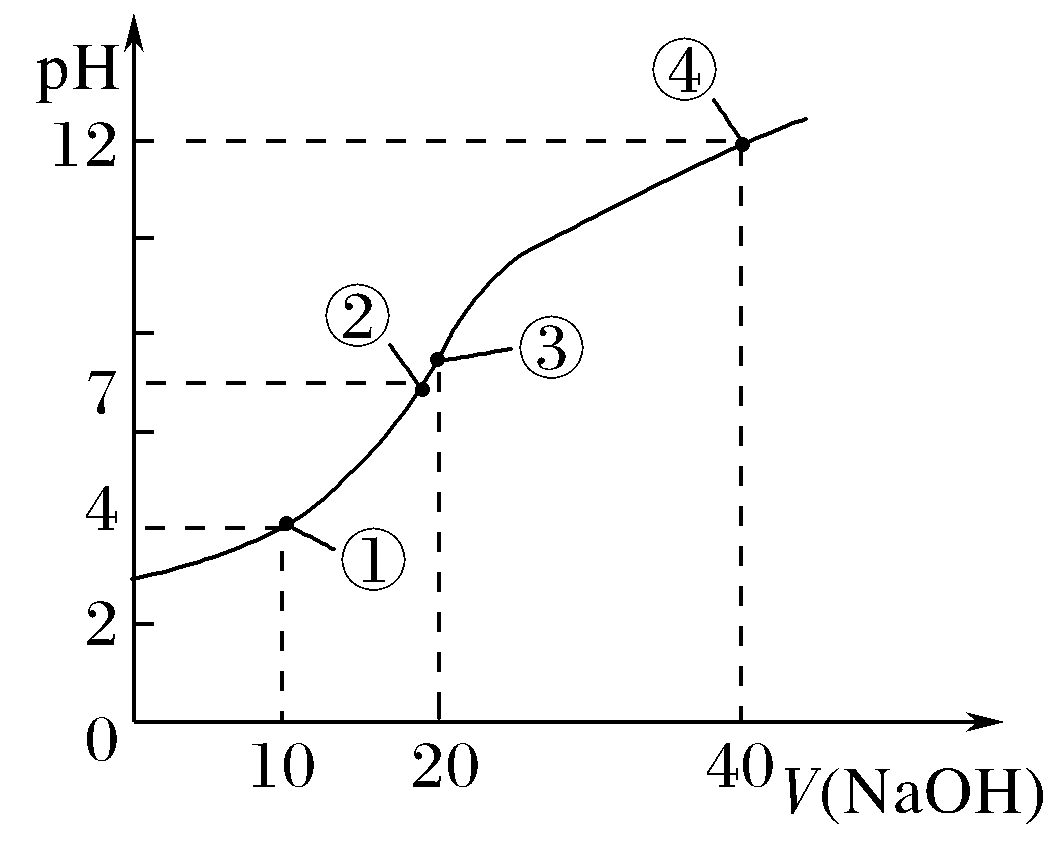
以室温时用0.1mol·L-1NaOH溶液滴定0.1 mol·L-1HA溶液为例。
滴定曲线 | 关键点 | 离子浓度关系 |
| 原点(点0) | 原点为HA的单一溶液,0.1 mol·L-1 HA溶液pH>1说明HA是弱酸;c(HA)>c(H+)> c(A-)>c(OH-) |
反应一半点 (点①) | 两者反应生成等物质的量的NaA和HA混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
中性点 (点②) | 此时溶液pH=7,溶液是中性,酸没有完全被中和,c(Na+)=c(A-)>c(HA)>c(H+)=c(OH-) | |
恰好完全反应点(点③) | 此时二者恰好完全反应生成NaA,为强碱弱酸盐,溶液显碱性,c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+) | |
过量点 (点④) | 此时,NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,溶液显碱性,c(Na+)>c(OH-)>c(A-)>c(H+) |
五、典题真题分析
(2017·课标全国Ⅱ,12) 改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。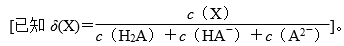
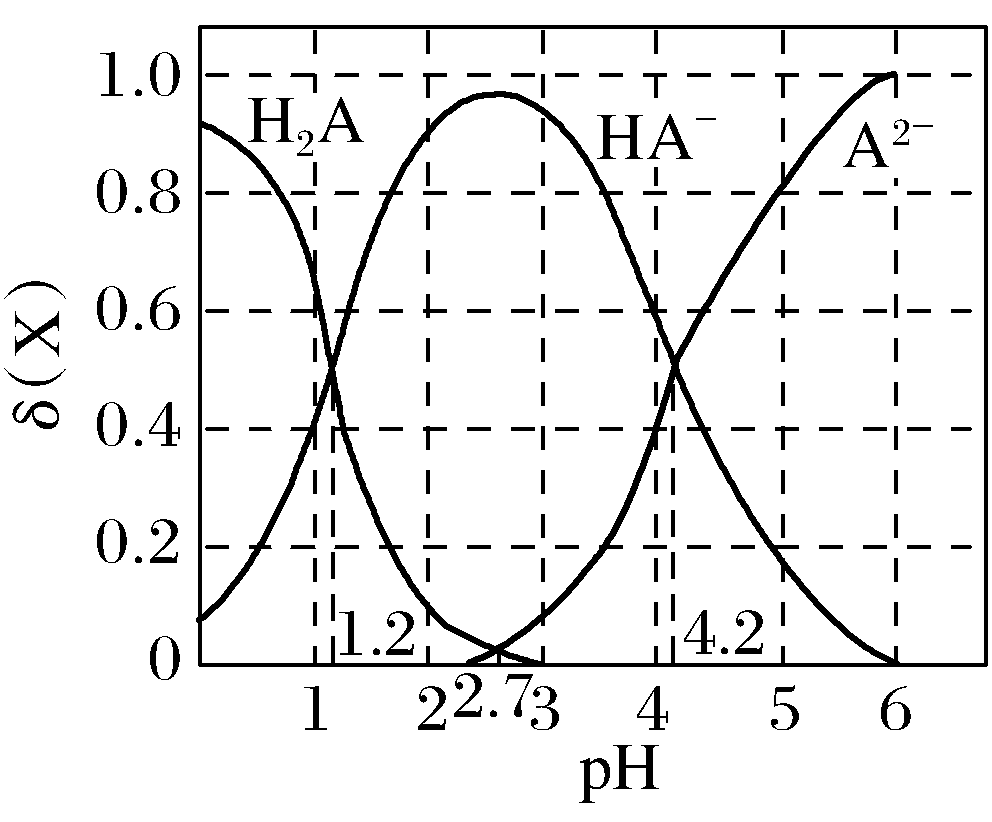
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【解析】A项,根据图像,pH=1.2时,H2A和HA-物质的量分数图像相交,则有c(H2A)=c(HA-),正确;
B项,根据pH=4.2点,K2(H2A)=[c(H+)·c(A2-)]/c(HA-)=c(H+)=10-4.2 mol·L-1,lg[K2(H2A)]=-4.2,正确;
C项,根据图像,pH=2.7时,H2A和A2-物质的量分数图像相交,则有c(H2A)=c(A2-),HA-曲线位于上方,则有c(HA-)>c(H2A)=c(A2-),正确;
D项,根据pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2 mol·L-1,可知c(HA-)=c(A2-)>c(H+),错误。答案D。