关注我们,了解更多连云港教育资讯
图像分析
命题特点
1.图像类型与高频考点
(1)溶解度曲线
命题形式:给出两种固体溶解度随温度变化的曲线,要求:比较T₁℃时溶解度大小(如NaCl vs. KNO₃);
计算饱和溶液降温后的析出晶体质量;判断"蒸发溶剂"与"降温结晶"的适用条件。
易错点:忽略曲线交点含义(该温度下溶解度相同)。
(2)pH变化曲线
典型场景:酸碱中和滴定曲线(如盐酸滴入NaOH溶液);金属氧化物与酸反应的pH变化(如氧化铜与硫酸)。
关键分析:突变点对应恰好完全反应,需结合化学方程式计算。
(3)质量变化曲线
常见实验背景:金属与酸反应产生氢气(如Mg、Zn、Fe与稀盐酸);碳酸盐分解(如CaCO₃高温分解的固体质量减少)。
陷阱设置:横坐标可能为"时间"或"酸的质量",影响斜率解读。
(4)其他图像
导电性变化(如Ba(OH)₂溶液中滴加H₂SO₄);反应速率曲线(催化剂对H₂O₂分解的影响)。
解题策略:明变量:标注横纵坐标的物理量及单位(如"时间/s" vs. "溶液质量/g");析拐点:分段解读曲线趋势变化(平台期:反应终止或达到饱和;陡升/降:快速反应阶段);联方程:将图像关键点(如最高点、转折点)代入化学方程式定量计算。
解题要领
(一)化学反应过程图像(1)金属与酸/盐反应判断金属活动性顺序:反应速率快→金属活动性强;生成氢气质量与金属价态、质量有关。易错点:酸不足时,金属剩余质量与金属种类无关。(2)溶液pH变化酸碱中和反应中,pH曲线转折点对应中和终点;稀释或混合时,pH变化趋势需结合溶质性质。(3)质量守恒相关图像生成气体或沉淀的质量随时间变化曲线,转折点表示反应结束。(二)溶解过程中溶质质量、溶液质量、溶质质量分数相关曲线判断
(1)溶质质量:
向不饱和溶液中加溶质,溶质质量随时间增加至溶解度后不再变化。
(2)溶质质量分数:
饱和溶液中加溶质,质量分数不变;不饱和溶液中加溶质,质量分数逐渐增大至饱和。
(3)溶液质量:
加溶质时,溶液质量增加;若溶质不溶(如Ca(OH)₂加CaO),溶液质量可能先减少后恢复。
过程 | 一定温度下,向一定量的水中加入A溶质 | 一定温度下,向一定量A的不饱和溶液中加入A | 一定温度下,向一定量A的饱和溶液中加入A | 一定温度下,向一定量A的饱和溶液中加入B |
图像 |
(三)pH变化与反应进程酸碱中和滴定曲线中,过量试剂(酸或碱)的pH趋势需结合溶质性质判断。强酸/强碱稀释后的pH变化幅度大于弱酸/弱碱。
(四)溶解过程中的温度变化曲线判断
(1)放热溶解:如NaOH、CaO溶于水,温度先升高后逐渐恢复。
(2)吸热溶解:如NH₄NO₃溶于水,温度持续降低。
过程 | 向一定量水中加入少量氢氧化钠固体(或浓硫酸) | 向一定量水中加入少量硝酸铵固体 |
图像 | ||
分析 | 溶质溶解(或生石灰与水反应)时放热,温度升高后随时间的变化而慢慢恢复至室温 | 溶质溶解时吸热,温度降低,后随时间的变化而慢慢恢复至室温 |
题型01 微观示意图分析
1.(2024·江苏苏州)(节选)天然气的综合利用是重要的研究课题。
天然气是重要的化石燃料和能源,主要成分为甲烷(CH4),还含有少量硫化氢(H2S)等气体。硫化氢可在催化剂作用下与甲烷反应而除去,其反应微观示意图如图1所示。
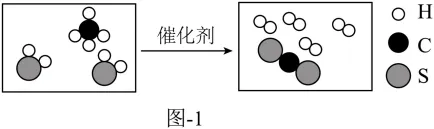
(1)甲烷完全燃烧生成CO2和H2O的化学方程式为______。
(2)结合图1,分析甲烷与硫化氢的反应。
①产物“”中,碳元素和硫元素的质量比为______(填最简整数比)。
②该反应过程中变化的是______(填字母)。
A.分子的数目 B.原子的种类 C.物质的总质量
【答案】(1)
(2) ①. 3:16②. A
【解析】【小问1详解】
甲烷完全燃烧生成二氧化碳和水,该反应的化学方程式为:;
【小问2详解】
①产物“”的化学式为:CS2,CS2中碳元素和硫元素的质量比为:;
②A、由图可知,该反应为甲烷和硫化氢在催化剂的作用下反应生成CS2和氢气,该反应的化学方程式为:,由化学方程式可知,化学反应前后,分子的数目发生了改变,反应前是3个,反应后是5个,符合题意;
B、根据质量守恒定律,化学反应前后,原子的种类和数目不变,不符合题意;
C、根据质量守恒定律,化学反应前后,物质的总质量不变,不符合题意。
故选A;
2(2023年苏州中考)(节选)与在催化剂作用下可得到合成气(CO和),反应过程中催化剂表面还同时存在积碳反应和消碳反应,原理如图-1所示。
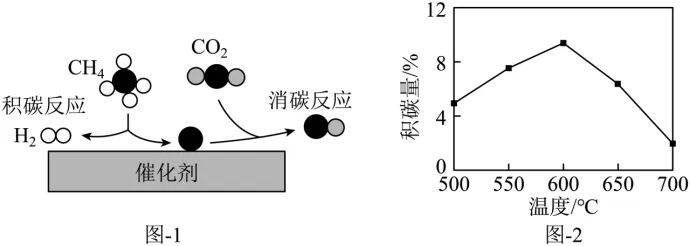
①消碳反应的产物“”是______。
②为减少催化剂表面的积碳,可在原料气中加入适量______气体。
③其他条件不变,催化剂表面的积碳量随温度变化如图-2所示。温度高于600℃,催化剂表面积碳量减少的原因可能是______。
【答案】①. CO②. 氧气③. 温度升高,消碳反应所消耗的碳的量多于积碳反应产生的碳
【解析】①由图可知,为碳原子、为氧原子,则为CO。
②由于碳能与氧气反应生成二氧化碳从而完成消碳反应,则可在原料中加入适量氧气,从而减少积碳。
③温度高于600℃,催化剂表面积碳量减少的原因可能是温度升高,消碳反应所消耗的碳的量多于积碳反应产生的碳。
题型02 物质间反应的质量分析
3.(2024·苏州中考)(节选)“氧化”时,次氯酸钠投入质量m(NaClO)对废水中的氨氮去除率(×100%)和总氮残留率(×100%)的影响如图所示。
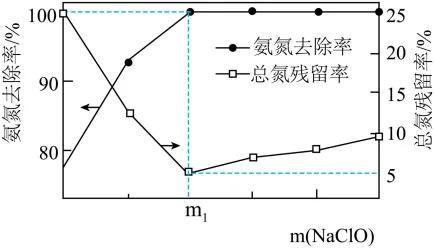
①NaClO将NH3反应转化为N2的化学方程式为_______。
②当m(NaClO)>m1时,废水中总氮残留率上升的原因是______。
【答案】①. 3NaClO+2NH3=N2+3NaCl+3H2O②. 部分氨气被转化为NO或NO,留在废水中
【详解】①NaClO与NH3反应生成氮气、氯化钠和水,反应的化学方程式为:3NaClO+2NH3=N2+3NaCl+3H2O;
②从图可以看出,当m(NaClO)>m1时,废水中总氮残留率上升,但氨氮去除率为100%,则说明氮元素不以氨气或铵根离子的形式残留。结合“已知:水体中的氮元素通常以氨氮、硝氮形式存在。”可知,此时废水中的氮元素以硝氮形式存在。所以废水中总氮残留率上升,是因为部分氨气被转化为或,留在废水中。
4.(2024苏州中考)捕集空气中CO2加氢制甲醇(CH3OH),可实现CO2资源化利用和“零碳”排放,其转化流程如图所示。下列说法不正确的是
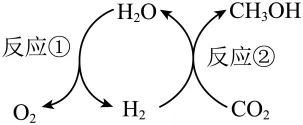
A. 反应①中,电解水生成的H2和O2的分子个数比为2:1
B. 反应②中,生产1.6kgCH3OH理论上要消耗2.2kgCO2
C. 转化过程中,H2O和H2循环转化,无需额外补充
D. 等质量的甲醇制取时消耗的CO2与燃烧时生成的CO2相等,实现“零碳”排放
【答案】C
【解析】
【详解】A、反应①水通电分解生成氢气和氧气,化学方程式为:,由化学方程式可知,电解水生成的H2和O2的分子个数比为2:1,故A说法正确;
B、反应②中,二氧化碳和氢气反应生成甲醇和水,根据碳元素质量守恒,则生产1.6kgCH3OH理论上要消耗CO2的质量为,故B说法正确;
C、反应①水通电分解生成氢气和氧气,化学方程式为:,反应②为二氧化碳和氢气反应生成甲醇和水,化学方程式为:,综合方程式为:,故转化过程中,H2O和H2虽然可循环转化,但是也需额外补充,故C说法错误;
D、甲醇和氧气点燃生成二氧化碳和水,化学方程式为:,二氧化碳和氢气反应生成甲醇和水,化学方程式为:,由化学方程式可知,甲醇和二氧化碳的分子个数比均为1:1,故等质量的甲醇制取时消耗的CO2与燃烧时生成的CO2相等,可实现“零碳”排放,故D说法正确;
故选:C。
推荐阅读:详解初中英语语法
需要完整电子版的家长,转发本文章到朋友圈一天以后,然后截图直接私信下方青山老师
为防止走失,请关注以下公众号,并加上星标,我们持续输出更多学习资料,敬请保持关注!






