在初中化学中,氧气是第一块敲门砖,也是中考必考点。本文深度拆解“空气含量测定”与“实验室制取”两大核心实验,带你从原理到实操,彻底吃透考点,轻松拿下实验分!
一、空气中氧气含量的测定
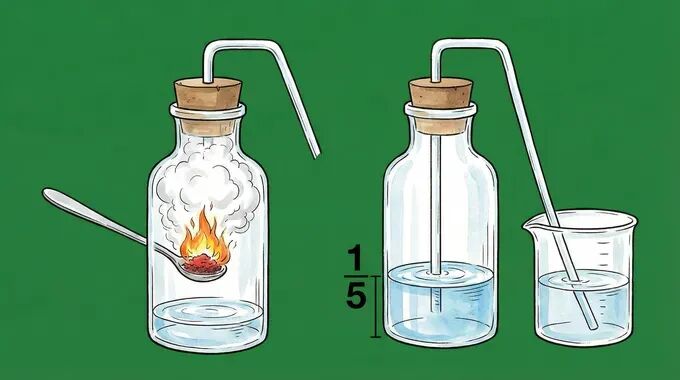
这个实验是化学史上的经典。核心逻辑很简单:通过化学反应消耗密闭容器中的氧气,造成压强差,从而测量体积。
1. 实验原理与核心考点
利用红磷燃烧消耗集气瓶内的氧气,导致瓶内气压减小。在大气压作用下,水被压入集气瓶。进入水的体积 ≈ 消耗掉的氧气体积。
4P + 5O₂ 点燃 2P₂O₅
2. 实验现象(满分描述)
- ● 燃烧时:
红磷剧烈燃烧,放出大量的热,产生大量的白烟。 - ● 冷却后:
打开弹簧夹,水沿导管进入集气瓶。 - ● 结果:
进入水的体积约占集气瓶体积的五分之一。
3. 注意事项(避坑指南)
为了保证实验成功,必须记牢以下细节,否则考试容易失分:
- 红磷要过量:
必须确保集气瓶内的氧气被完全消耗,否则结果偏小。 - 气密性检查:
装置气密性必须良好,否则外部空气进入,导致结果偏小。 - 冷却至室温:
必须等装置冷却至室温后才能打开弹簧夹。气体受热膨胀,未冷却就打开会导致进入的水量偏少。
🤔 难点突破:为什么只能用红磷?
❌ 铁丝:在空气中不能燃烧,只能在纯氧中燃烧。
❌ 木炭/硫:燃烧产物是气体(CO₂/SO₂),瓶内压强几乎不变,水无法进入。
❌ 镁条:不仅和氧气反应,还和氮气、二氧化碳反应,导致结果偏大。
二、氧气的实验室制取
实验室制取氧气主要有三种方法,发生装置的选择依据只有两点:反应物的状态 + 反应条件。
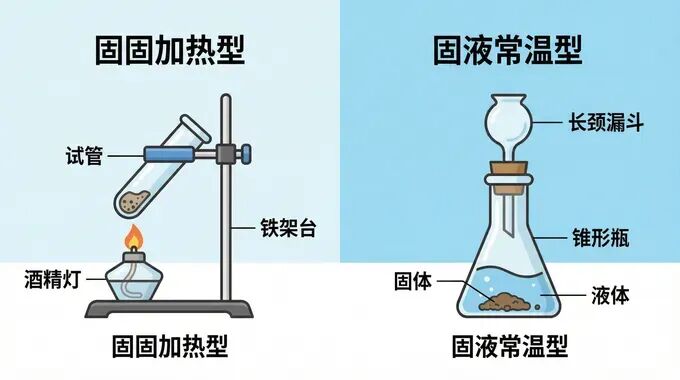
1. 高锰酸钾制氧 (固固加热型) 2KMnO₄ △K₂MnO₄+MnO₂+O₂↑ 装置要点:试管口略向下倾斜,防止冷凝水回流炸裂试管。 | 2. 过氧化氢制氧 (固液不加热型) 2H₂O₂ MnO₂2H₂O+O₂↑ 装置要点:常用长颈漏斗,便于随时添加液体。MnO₂起催化作用。 |
三、气体的收集与验满
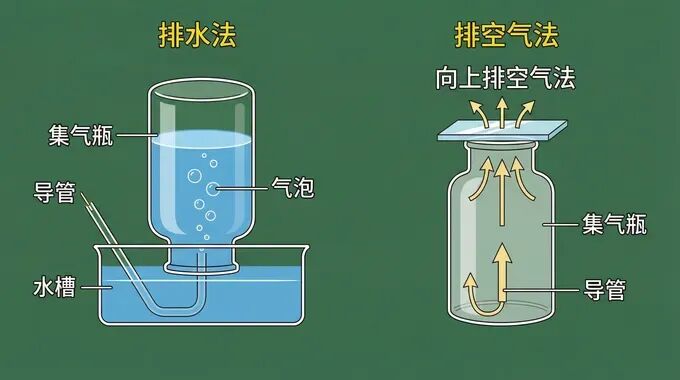
根据氧气密度比空气大、不易溶于水的物理性质,我们有两种收集方法:
四、重点难点突破
1. 高锰酸钾制氧“七字诀”
记住口诀:查-装-定-点-收-离-熄。
⚠️ 致命细节:
棉花:试管口塞一团棉花,防止粉末堵塞导管。
撤离顺序:实验结束,先移导管出水面,再熄灭酒精灯。防止水槽中的水倒吸,炸裂试管。
2. 多功能瓶的“七十二变”
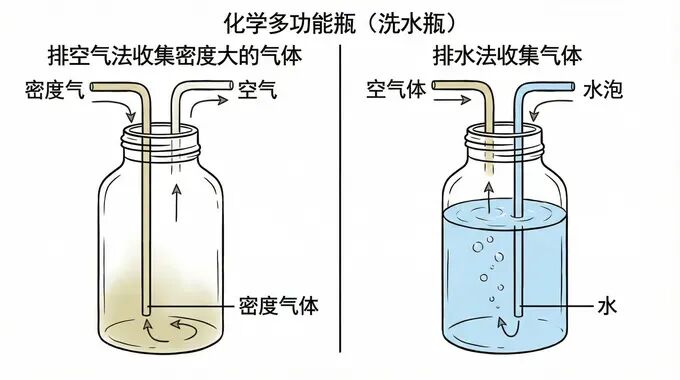
别被“万能瓶”绕晕,记住这个简单的物理逻辑:
✅ 排空气法收集氧气(密度大):气体沉底,把空气往上挤 ➡ 长进短出。 ✅ 排水法收集(瓶装满水):水只能从长管出,气体从上面进 ➡ 短进长出。
掌握了这两个实验,你不仅掌握了氧气的性质,更掌握了化学探究的基本方法论。收藏本文,考前拿出来看一遍,实验题不再丢分!







