中考化学盐和化肥知识点梳理归纳
四季读书网
45
1、盐的概念:由金属阳离子(或NH4+)和酸根阴离子组成的化合物;或者能解离出金属离子(或NH4+)和酸根离子的化合物。物 质 | 俗 称 | 物理性质 | 用 途 |
氯化钠 NaCl | 食 盐 | 白色粉末,水溶液有咸味, 溶解度受温度影响不大 | (1)作调味品(2)作防腐剂 (3)消除积雪(降低雪的熔点) (4)农业上用NaCl溶液来选种 (5)制生理盐水(0.9% NaCl溶液) Na+ 维持细胞内外的水分分布,促进细胞内外物质交换Cl- 促生盐酸、帮助消化,增进食欲 |
碳酸钠 Na2CO3 | 纯碱(因水溶液呈碱性)、苏打 | 白色粉末状固体,易溶于水 | 用于玻璃、造纸、纺织、洗涤、食品工业等 |
碳酸氢钠 NaHCO3 | 小苏打 | 白色晶体, 易溶于水 | 制糕点所用的发酵粉 医疗上,治疗胃酸过多 |
碳酸钙 CaCO3 | 石灰石、大理石 | 白色固体 难溶于水 | 建筑材料、补钙剂 |
备注 | 1、粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。 (无水氯化钙可用作干燥剂) 2、碳酸钠从溶液中析出时,会结合一定数目的水分子, 化学式为Na2CO3·10H2O。 碳酸钠晶体Na2CO3·10H2O(纯净物),俗称天然碱、石碱、口碱。 风化:常温时在空气中放置一段时间后,失去结晶水而变成粉末。(化学变化) Na2CO3·10H2O= Na2CO3+10H2O 3、2Na H CO3 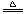 NaHCO3+HCl===NaCl+ H2O+ CO2↑ |
3、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。实验步骤 | 实验仪器 | 其中玻璃棒的作用 |
研磨 | 研磨钵 | / |
溶解 | 烧杯、玻璃棒 | 加速溶解 |
过滤 | 铁架台(带铁圈)、漏斗、烧杯、玻璃棒 | 引流,防止液体溅出漏斗外 |
蒸发 | 铁架台(带铁圈)蒸发皿、酒精灯、玻璃棒 | 使液体受热均匀,防止液体飞溅 |
①与酸的反应:2HCl + CaCO3 = CaCl2 + H2O + CO2↑②高温分解:CaCO3 CaO + CO2 ↑2)、碳酸钠的化学性质:(这两个反应可用于检验NaOH是否变)①与酸的反应: 2HCl + Na2CO3 = 2NaCl + H2O + CO2↑②与碱溶液的反应;Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOHHCl + NaHCO3 = NaCl + H2O + CO2↑⑴ 取样少许与试管中,加入稀HCl,若有无色气泡产生,然后将该气体通入澄清石灰水中,石灰水变浑浊,则证明存在CO32-2HCl + CaCO3 = CaCl2 + H2O + CO2↑Ca(OH) 2 + CO2 ==== CaCO 3↓+ H2 O⑵ 加入石灰水或Ba(OH)2溶液,若溶液变浑浊,然后加入稀盐酸浑浊消失,则存在CO32-Ca(OH)2+Na2CO3=CaCO3↓+2NaOH2HCl +CaCO3 = CaCl2+ H2O+CO2↑⑶ 加入CaCl2或Ca(NO3)2溶液,若液体变浑浊,则有存在CO32-CaCl2+ Na2CO3= CaCO3↓+2NaClCa(NO3)2+ Na2CO3= CaCO3↓+2Na(NO3)2盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,K、Ca、Na除外)反应类型:置换反应Fe + CuSO4 == Cu + FeSO4 (“古代湿法炼铜”原理)2Al + 3CuSO4 = Al2(SO4)3 + 3Cu Cu + 2AgNO3 = Cu(NO3)2 + 2Ag盐 + 酸 → 新盐 + 新酸(满足复分解反应的条件)反应类型:复分解反应H2SO4 + BaCl2 =BaSO4 ↓+ 2HCl(注BaSO4沉淀:白色,不溶于稀硝酸)2HCl + Na2CO3 = 2NaCl + CO2↑+ H2O2HCl + CaCO3 = CO2↑+ CaCl2 + H2OHCl + NaHCO3 = H2O + NaCl +CO2↑HCl + AgNO3 = HNO3 + AgCl↓ (注AgCl沉淀:白色,不溶于稀硝酸)盐 + 碱 → 新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 现象:出现蓝色沉淀(注:CuSO4 溶液:蓝色 Cu(OH)2沉淀:蓝色)3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl 现象:出现红褐色沉淀(注:FeCl3溶液:黄色 Fe(OH)3沉淀:红褐色)Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH 现象:澄清石灰水变浑浊盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)NaCl + AgNO3 = AgCl ↓+ NaNO3 现象:出现白色沉淀Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl 现象:出现白色沉淀概念:由两种化合物互相交换成分,生成另外两种化合物的反应条件:生成物:有沉淀或有气体或有水生成时,复分解反应才可以发生.RHCO3 /RCO3 + 酸 → 另一种盐 + CO2 + H2O(1)生成沉淀物:Cl-与Ag+、 Ba2+ 与SO42-、OH-与Cu2+、Fe3+(2)生成气体:OH-与NH4+ 、H+和CO32-此外要注意:题目要求的在酸性溶液还是碱性溶液、或者溶液是无色还是有色常见的有色离子:Fe3+黄色、Fe2+浅绿色、Cu2+蓝色、MnO4-紫色
CaO + CO2 ↑2)、碳酸钠的化学性质:(这两个反应可用于检验NaOH是否变)①与酸的反应: 2HCl + Na2CO3 = 2NaCl + H2O + CO2↑②与碱溶液的反应;Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOHHCl + NaHCO3 = NaCl + H2O + CO2↑⑴ 取样少许与试管中,加入稀HCl,若有无色气泡产生,然后将该气体通入澄清石灰水中,石灰水变浑浊,则证明存在CO32-2HCl + CaCO3 = CaCl2 + H2O + CO2↑Ca(OH) 2 + CO2 ==== CaCO 3↓+ H2 O⑵ 加入石灰水或Ba(OH)2溶液,若溶液变浑浊,然后加入稀盐酸浑浊消失,则存在CO32-Ca(OH)2+Na2CO3=CaCO3↓+2NaOH2HCl +CaCO3 = CaCl2+ H2O+CO2↑⑶ 加入CaCl2或Ca(NO3)2溶液,若液体变浑浊,则有存在CO32-CaCl2+ Na2CO3= CaCO3↓+2NaClCa(NO3)2+ Na2CO3= CaCO3↓+2Na(NO3)2盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,K、Ca、Na除外)反应类型:置换反应Fe + CuSO4 == Cu + FeSO4 (“古代湿法炼铜”原理)2Al + 3CuSO4 = Al2(SO4)3 + 3Cu Cu + 2AgNO3 = Cu(NO3)2 + 2Ag盐 + 酸 → 新盐 + 新酸(满足复分解反应的条件)反应类型:复分解反应H2SO4 + BaCl2 =BaSO4 ↓+ 2HCl(注BaSO4沉淀:白色,不溶于稀硝酸)2HCl + Na2CO3 = 2NaCl + CO2↑+ H2O2HCl + CaCO3 = CO2↑+ CaCl2 + H2OHCl + NaHCO3 = H2O + NaCl +CO2↑HCl + AgNO3 = HNO3 + AgCl↓ (注AgCl沉淀:白色,不溶于稀硝酸)盐 + 碱 → 新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 现象:出现蓝色沉淀(注:CuSO4 溶液:蓝色 Cu(OH)2沉淀:蓝色)3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl 现象:出现红褐色沉淀(注:FeCl3溶液:黄色 Fe(OH)3沉淀:红褐色)Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH 现象:澄清石灰水变浑浊盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)NaCl + AgNO3 = AgCl ↓+ NaNO3 现象:出现白色沉淀Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl 现象:出现白色沉淀概念:由两种化合物互相交换成分,生成另外两种化合物的反应条件:生成物:有沉淀或有气体或有水生成时,复分解反应才可以发生.RHCO3 /RCO3 + 酸 → 另一种盐 + CO2 + H2O(1)生成沉淀物:Cl-与Ag+、 Ba2+ 与SO42-、OH-与Cu2+、Fe3+(2)生成气体:OH-与NH4+ 、H+和CO32-此外要注意:题目要求的在酸性溶液还是碱性溶液、或者溶液是无色还是有色常见的有色离子:Fe3+黄色、Fe2+浅绿色、Cu2+蓝色、MnO4-紫色离子 | 加入试剂 | 主要实验现象 |
H+ | 紫色石蕊试液、较活泼金属 | 变红色、有氢气产生 |
OH- | 无色酚酞 | 变红 |
Cl- | 硝酸银溶液及稀硝酸 | 白色沉淀 |
SO42- | 硝酸钡溶液及稀硝酸 | 白色沉淀 |
CO32- | 稀盐酸和澄清石灰水 | 产生能使澄清石灰水变浑浊的气体 |
Cu2+ | NaOH溶液 | 蓝色沉淀 |
Fe3+ | NaOH溶液 | 红褐色沉淀 |
NH4+ | 先加碱溶液,加热,再用湿润的紫色石蕊试纸试验 | 有无色气体产生,试纸变蓝 |
物理方法:利用物质的溶解性、磁性、沸点等物理性质的差异分离化学方法:①化气法:像混合物中加入某种试剂,使混合物中的杂质变为气体逸出方法:加入HCl Na2CO3 +HCl=NaCl+H2O+CO2↑沉淀法:向混合物中加入某种试剂,使该试剂与杂质放映转化成沉淀,再经过虑除掉沉淀,以除杂质方法:加入BaCl,过滤除去杂质 NaSO4=BaSO4+NaCl方法:高温加热 CaCO3 CaO + CO2 ↑溶解法:向混合物中加入某种试剂,使杂质与试剂反应而被溶解掉,以除去杂质方法:加入稀HCl,再经过过滤而除去 CuO+HCl=CuCl2+ H2O置换法:向混合物中加入一种单质,是单质与杂质反应,而被除去方法:向其加入足量的铁粉 Fe+ CuSO4=Cu+FeSO4吸收法:将气体混合物通过洗气装置,杂质被洗气装置的试剂吸收而除去方法:将混合气体通过盛有足量的NaOH溶液的洗气装置 2NaOH+CO2=Na2CO3+H2O农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构(1)、作用:促进植物茎、叶生长茂盛、叶色浓绿(促叶)。含N量 | 使用注意事项 |
|
NH4HCO3 17.7% | 易分解,施用时深埋 | 铵态氮肥防晒防潮,且均不能与碱性物质(如草木灰、熟石灰等)混合施用 |
(NH4)2SO4 21.2% | 长期使用会使土壤酸化、板结 |
|
NH4Cl 26.2% | 长期使用会使土壤酸化、板结 |
|
CO(NH2)2 46.7% | 含氮量最高的氮肥 (有机物) |
|
NH3. H2O 15-18% | 加水稀释后施用 | 不稳定,易放出NH3↑ |
NaNO3 16.5% |
|
|
(4)、生物固氮:豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆)。常用钾肥 草木灰:农村最常用钾肥(主要成分为K2CO3), 呈碱性作用:促进植物根系发达,穗粒增多,饱满(催果),抗旱抗寒促进作物提早成熟
| 氮 肥 | 钾 肥 | 磷 肥 |
看外观 | 白 色 晶 体 | 灰白色粉末 |
加 水 | 全 部 溶 于 水 | 大多数不溶于水 |
灼烧 | 可燃烧,熔化起泡冒烟 | 不燃烧,跳动、爆裂声 |
|
加Ca(OH)2 | 放出氨气 | 不放出氨气 |
|
(1)土壤污染:重金属元素、有毒有机物、放射性物质(3)引起水体污染 :N、P过多,导致水体富营养化,赤潮、水华等现象
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至23467321@qq.com举报,一经查实,本站将立刻删除;如已特别标注为本站原创文章的,转载时请以链接形式注明文章出处,谢谢!
 CaO + CO2 ↑
CaO + CO2 ↑