致各位读者:因为公众号平台改变了推送规则,如果想正常看到“木木谈化学”的推送,需要大家在阅读后,在文末右下角点一下“在看”或者将公众号设为“星标”,我们每次的新文章才会第一时间出现在您的订阅列表里。
人海茫茫,不想和大家错过,感谢您一如既往的支持!
如何联系小编:
(1)添加微信号mmthx0123
(2)直接私信小编

知识要点
我们天天都吃的食盐,首先经过盐场晒盐,只是把水分蒸发掉了,得到的是粗盐,里面还混有泥土和其他的杂质,在实验室中怎样除去杂质呢?

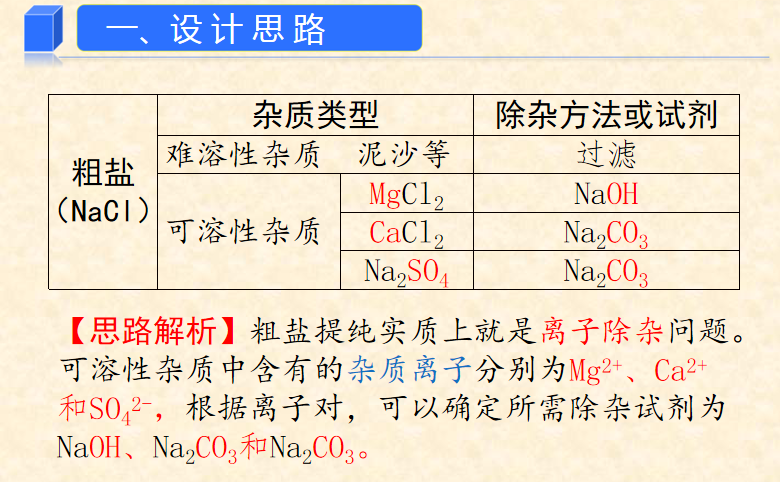
粗盐成分:不溶性泥沙、可溶性杂质(CaCl2、MgCl2及SO42-)
(一)溶解

仪器:烧杯、玻璃棒
(二)过滤
(1)原理:利用物质溶解性的差异,将液体与不溶于液体的固体分离的方法。
(2)主要仪器:漏斗、烧杯、玻璃棒、铁架台(带铁圈)、滤纸。
(3)装置图:

(4)注意: "一贴、两低、三靠"
例题1、某学生发现滴瓶中的溶液有悬浮物,拟用右图所示操作进行过滤,操作上错误的地方有
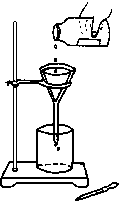
A.4 处 B.3 处
C.2 处 D.1 处
练习:写出上述错误,并改正
(三)蒸发
(1)原理:分离溶于溶剂中的溶质。
(2)主要仪器:蒸发皿、酒精灯、玻璃棒,铁架台。
(3)装置图:

(4)注意:a蒸发过程中要不断搅拌。b 在加热至有大量固体析出时,要用余温加热;c热的蒸发皿不能直接放在实验台上,以免烫坏实验台或遇实验台上冷水引起蒸发皿炸裂,取用它用坩埚钳。
例题1、实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯 ②固定铁圈位置 ③放置蒸发皿 ④加热搅拌 ⑤停止加热,余热蒸干。其中正确的操作顺序是( )
A.②③④⑤① B.①②③④⑤
C.②③①④⑤ D.②①③④⑤
练习1、下列实验操作中有错误的是( )
A. 过滤时,玻璃棒与三层滤纸的一边接触
B. 过滤时,漏斗下端紧贴烧杯内壁
C. 蒸发时,加入的液体不超过蒸发皿容积的2/3
D. 蒸发时,加热持续到把水蒸干为止
练习2、提纯含有少量泥沙的粗盐,下列操作顺序正确的是( )
A.过滤、蒸发、结晶、溶解
B.溶解、蒸发、过滤、结晶
C.溶解、蒸发、结晶、过滤
D.溶解、过滤、蒸发、结晶
练习3、粗盐提纯实验必须使用的一组仪器是( )
A.烧杯、玻璃棒、漏斗、蒸发皿、酒精灯
B.量筒、烧杯、试管夹、蒸发皿、铁架台
C.漏斗、玻璃棒、镊子、蒸发皿、铁架台
D.试管、量筒、药匙、玻璃棒、酒精灯
(四)结晶
原理:利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。而让杂质全部或大部分仍留在溶液中,从而达到提纯的目的。
①蒸发结晶:通过蒸发或汽化,减少一部分溶剂达到饱和而析出晶体。
(用于溶解度随温度改变而变化不大的物质。)
②冷却结晶:通过降低温度,使溶液冷却达到饱和而析出晶体。
重结晶指的是重复冷却结晶(用于溶解度随温度下降而明显减小的物质)。
练习1、下列叙述中正确的是( )
A.海水一经降温,就会有大量食盐晶体析出
B.加热蒸发硝酸钾溶液,开始时就会有大量硝酸钾晶体析出
C.硝酸钾的饱和溶液还可以溶解硝酸钾
D.将析出硝酸钾晶体后的溶液再冷却,仍然有硝酸钾晶体析出
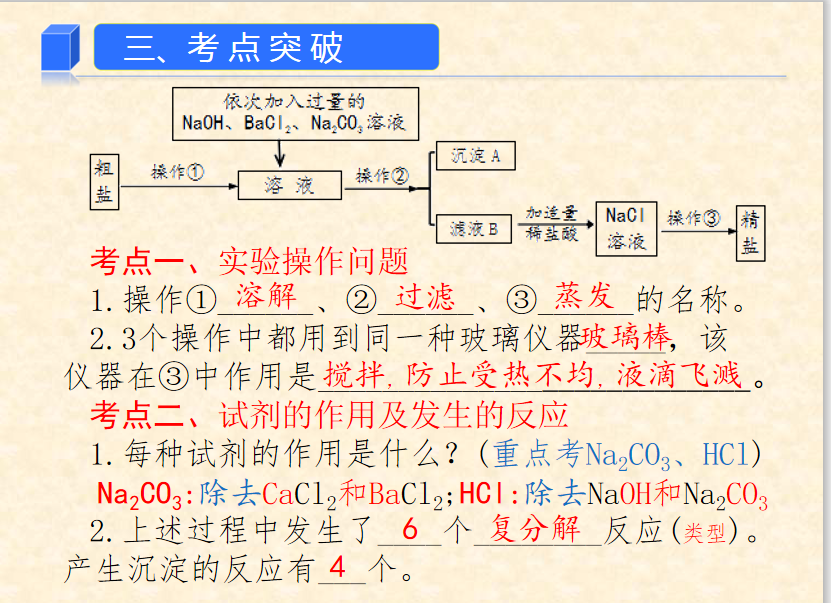
(五)除去可溶性杂质CaCl2、MgCl2及SO42-
★1、SO42-的检验
取少量食盐,配制成溶液,先滴入几滴稀盐酸,然后向试管中滴入几滴BaCl2溶液,观察现象。
实验现象:滴入盐酸后,无新现象产生,再加BaCl2溶液,则有白色沉淀生成。
滴加稀盐酸的目的是什么?写出反应的化学方程式?
★2、除杂
杂质 | 加入的试剂 | 化学方程式 |
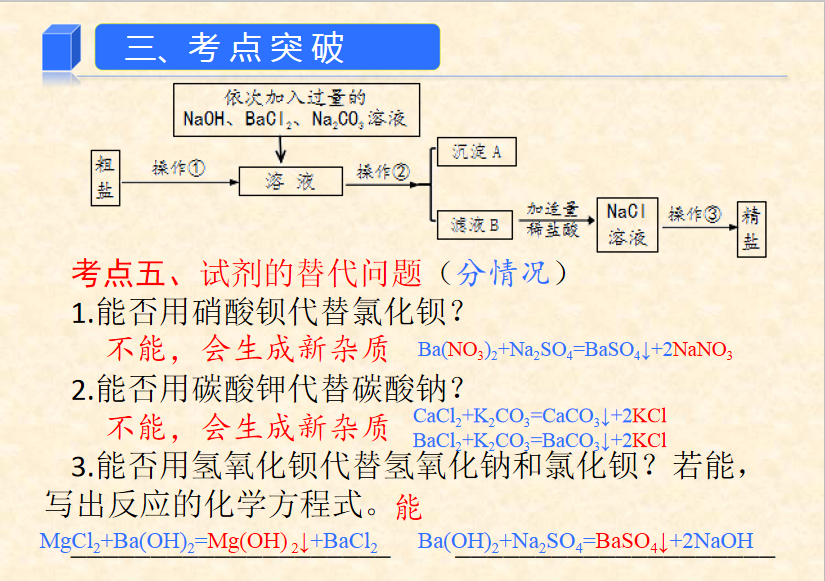
硫酸盐 SO42- | BaCl2 | Na2SO4+BaCl2=BaSO4↓+2NaCl |
MgCl2 | NaOH | MgCl2+2NaOH=Mg(OH)2↓+2NaCl |
CaCl2 | Na2CO3 | Na2CO3+CaCl2=CaCO3↓+2NaCl |
Na2CO3+BaCl2=BaCO3↓+2NaCl | ||
HCl | Na2CO3+2HCl=CO2↑+H2O+2NaCl HCl+NaOH=NaCl+H2O |
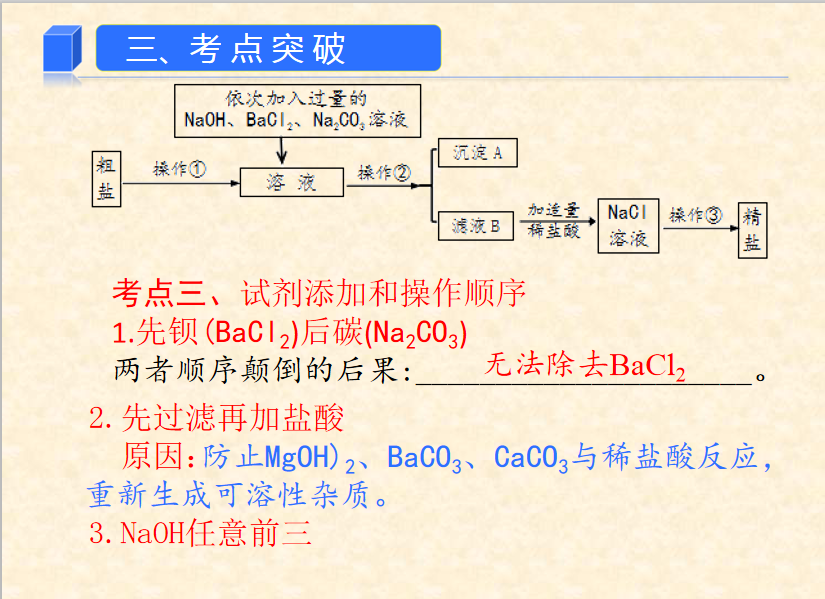
★3、滴加顺序
(1)BaCl2——Na2CO3——NaOH——HCl
(2)BaCl2——NaOH——Na2CO3——HCl
(3)NaOH——BaCl2——Na2CO3——HCl
总结:溶液中可溶性杂质的除去原则
(1)不增 提纯过程中不能引入新的杂质
(2)不减 不减少被提纯的物质
(3)易分离 被提纯的物质与杂质容易分离
(4)易复原 被提纯物质要复原
例题1、根据从草木灰中提取钾盐(碳酸钾、氯化钾、硫酸钾)的实验,填写下列空白:
(1)此实验操作顺序如下:
①称量样品②溶解、沉降③ ④ ⑤冷却结晶
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示
A 左盘重,样品轻 B左盘轻,砝码重 C 右盘重,砝码轻 D右盘轻,样品重
(3)在进行第③步操作时,有可能要重复进行,这是由于
(4)在进行第③步操作时,要用玻璃棒不断小心地搅动液体,目的是防止 。
(5)所得产物中主要的钾盐有 等。
例题2、在粗盐提纯的实验中,蒸发时正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中发现大量固体时即停止加热
练习1、下列是有关实验操作的步骤和做法,不正确的是( )
A.粗盐提纯操作的顺序是:溶解、过滤、蒸发、洗涤
B.实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热
C.不慎将浓硫酸洒在桌上,应先用烧碱溶液中和,再用湿布抹净
D.用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部
练习2、在粗盐的提纯实验中,用到玻璃棒的实验步骤有 、 、 。
我们天天都吃的食盐,首先经过盐场晒盐,只是把水分蒸发掉了,得到的是粗盐,里面还混有泥土和其他的杂质,在实验室中怎样除去杂质呢?

粗盐成分:不溶性泥沙、可溶性杂质(CaCl2、MgCl2及SO42-)
(一)溶解

仪器:烧杯、玻璃棒
(二)过滤
(1)原理:利用物质溶解性的差异,将液体与不溶于液体的固体分离的方法。
(2)主要仪器:漏斗、烧杯、玻璃棒、铁架台(带铁圈)、滤纸。
(3)装置图:

(4)注意: "一贴、两低、三靠"
例题1、某学生发现滴瓶中的溶液有悬浮物,拟用右图所示操作进行过滤,操作上错误的地方有
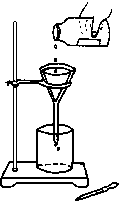
A.4 处 B.3 处
C.2 处 D.1 处
练习:写出上述错误,并改正
(三)蒸发
(1)原理:分离溶于溶剂中的溶质。
(2)主要仪器:蒸发皿、酒精灯、玻璃棒,铁架台。
(3)装置图:

(4)注意:a蒸发过程中要不断搅拌。b 在加热至有大量固体析出时,要用余温加热;c热的蒸发皿不能直接放在实验台上,以免烫坏实验台或遇实验台上冷水引起蒸发皿炸裂,取用它用坩埚钳。
例题1、实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯 ②固定铁圈位置 ③放置蒸发皿 ④加热搅拌 ⑤停止加热,余热蒸干。其中正确的操作顺序是( )
A.②③④⑤① B.①②③④⑤
C.②③①④⑤ D.②①③④⑤
练习1、下列实验操作中有错误的是( )
A. 过滤时,玻璃棒与三层滤纸的一边接触
B. 过滤时,漏斗下端紧贴烧杯内壁
C. 蒸发时,加入的液体不超过蒸发皿容积的2/3
D. 蒸发时,加热持续到把水蒸干为止
练习2、提纯含有少量泥沙的粗盐,下列操作顺序正确的是( )
A.过滤、蒸发、结晶、溶解
B.溶解、蒸发、过滤、结晶
C.溶解、蒸发、结晶、过滤
D.溶解、过滤、蒸发、结晶
练习3、粗盐提纯实验必须使用的一组仪器是( )
A.烧杯、玻璃棒、漏斗、蒸发皿、酒精灯
B.量筒、烧杯、试管夹、蒸发皿、铁架台
C.漏斗、玻璃棒、镊子、蒸发皿、铁架台
D.试管、量筒、药匙、玻璃棒、酒精灯
(四)结晶
原理:利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。而让杂质全部或大部分仍留在溶液中,从而达到提纯的目的。
①蒸发结晶:通过蒸发或汽化,减少一部分溶剂达到饱和而析出晶体。
(用于溶解度随温度改变而变化不大的物质。)
②冷却结晶:通过降低温度,使溶液冷却达到饱和而析出晶体。
重结晶指的是重复冷却结晶(用于溶解度随温度下降而明显减小的物质)。
练习1、下列叙述中正确的是( )
A.海水一经降温,就会有大量食盐晶体析出
B.加热蒸发硝酸钾溶液,开始时就会有大量硝酸钾晶体析出
C.硝酸钾的饱和溶液还可以溶解硝酸钾
D.将析出硝酸钾晶体后的溶液再冷却,仍然有硝酸钾晶体析出
(五)除去可溶性杂质CaCl2、MgCl2及SO42-
★1、SO42-的检验
取少量食盐,配制成溶液,先滴入几滴稀盐酸,然后向试管中滴入几滴BaCl2溶液,观察现象。
实验现象:滴入盐酸后,无新现象产生,再加BaCl2溶液,则有白色沉淀生成。
滴加稀盐酸的目的是什么?写出反应的化学方程式?
★2、除杂
杂质 | 加入的试剂 | 化学方程式 |
硫酸盐 SO42- | BaCl2 | Na2SO4+BaCl2=BaSO4↓+2NaCl |
MgCl2 | NaOH | MgCl2+2NaOH=Mg(OH)2↓+2NaCl |
CaCl2 | Na2CO3 | Na2CO3+CaCl2=CaCO3↓+2NaCl |
Na2CO3+BaCl2=BaCO3↓+2NaCl | ||
HCl | Na2CO3+2HCl=CO2↑+H2O+2NaCl HCl+NaOH=NaCl+H2O |
★3、滴加顺序
(1)BaCl2——Na2CO3——NaOH——HCl
(2)BaCl2——NaOH——Na2CO3——HCl
(3)NaOH——BaCl2——Na2CO3——HCl
总结:溶液中可溶性杂质的除去原则
(1)不增 提纯过程中不能引入新的杂质
(2)不减 不减少被提纯的物质
(3)易分离 被提纯的物质与杂质容易分离
(4)易复原 被提纯物质要复原
方法技巧
题型解析



例题精讲
例题1、根据从草木灰中提取钾盐(碳酸钾、氯化钾、硫酸钾)的实验,填写下列空白:
(1)此实验操作顺序如下:
①称量样品②溶解、沉降③ ④ ⑤冷却结晶
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示
A 左盘重,样品轻 B左盘轻,砝码重 C 右盘重,砝码轻 D右盘轻,样品重
(3)在进行第③步操作时,有可能要重复进行,这是由于
(4)在进行第③步操作时,要用玻璃棒不断小心地搅动液体,目的是防止 。
(5)所得产物中主要的钾盐有 等。
例题2、在粗盐提纯的实验中,蒸发时正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中发现大量固体时即停止加热
练习1、下列是有关实验操作的步骤和做法,不正确的是( )
A.粗盐提纯操作的顺序是:溶解、过滤、蒸发、洗涤
B.实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热
C.不慎将浓硫酸洒在桌上,应先用烧碱溶液中和,再用湿布抹净
D.用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部
练习2、在粗盐的提纯实验中,用到玻璃棒的实验步骤有 、 、
专题训练

点分享
点收藏
点点赞
点在看